2 英文参考
ciprofloxacin[湘雅医学专业词典]
3 国家基本药物
| 序号 | 基本药物目录序号 | 药品名称 | 剂型 | 规格 | 单位 | 零售指导价格 | 类别 | 备注 |
| 216 | 19 | 环丙沙星 | 片剂 | 250mg*10 | 盒(瓶) | 3.1元 | 化学药品和生物制品部分 | * |
| 217 | 19 | 环丙沙星 | 片剂 | 250mg*6 | 盒(瓶) | 1.9元 | 化学药品和生物制品部分 | |
| 218 | 19 | 环丙沙星 | 片剂 | 250mg*9 | 盒(瓶) | 2.8元 | 化学药品和生物制品部分 | |
| 219 | 19 | 环丙沙星 | 片剂 | 250mg*12 | 盒(瓶) | 3.7元 | 化学药品和生物制品部分 | |
| 220 | 19 | 环丙沙星 | 片剂 | 250mg*20 | 盒(瓶) | 6元 | 化学药品和生物制品部分 | |
| 221 | 19 | 环丙沙星 | 片剂 | 250mg*24 | 盒(瓶) | 7.2元 | 化学药品和生物制品部分 | |
| 222 | 19 | 环丙沙星 | 胶囊 | 250mg*10 | 盒(瓶) | 3.3元 | 化学药品和生物制品部分 | |
| 223 | 19 | 环丙沙星 | 胶囊 | 250mg*12 | 盒(瓶) | 3.9元 | 化学药品和生物制品部分 | |
| 224 | 19 | 环丙沙星 | 胶囊 | 250mg*16 | 盒(瓶) | 5.2元 | 化学药品和生物制品部分 | |
| 225 | 19 | 环丙沙星 | 胶囊 | 250mg*20 | 盒(瓶) | 6.4元 | 化学药品和生物制品部分 | |
| 226 | 19 | 环丙沙星 | 胶囊 | 250mg*24 | 盒(瓶) | 7.7元 | 化学药品和生物制品部分 | |
| 227 | 19 | 环丙沙星 | 注射剂 | 100mg:2ml | 瓶(支) | 1元 | 化学药品和生物制品部分 | * |
| 228 | 19 | 环丙沙星 | 注射剂 | 100mg:10ml | 瓶(支) | 1元 | 化学药品和生物制品部分 | |
| 229 | 19 | 环丙沙星 | 注射剂 | 200mg:100ml | 瓶(支) | 4.5元 | 化学药品和生物制品部分 | * |
注(化学药品和生物制品部分):
1、表中备注栏标注“*”的为代表品。
2、表中代表剂型规格在备注栏中加注“△”的,该代表剂型规格及与其有明确差比价关系的相关规格的价格为临时价格。
注(中成药部分):
2、表中备注栏加注“△”的剂型规格,及同剂型的其他规格为临时价格。
4 环丙沙星药典标准
4.1 品名
4.1.1 中文名
4.1.2 汉语拼音
Huanbingshaxing
4.1.3 英文名
Ciprofloxacin
4.2 结构式
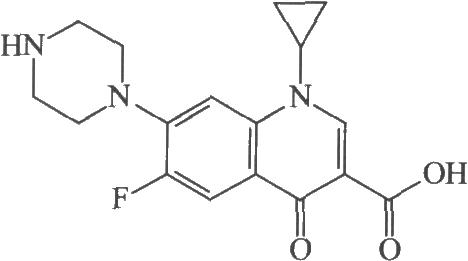
4.3 分子式与分子量
C17H18FN3O3 331.34
4.4 来源(名称)、含量(效价)
本品为1-环丙基-6-氟-1,4-二氢-4-氧代-7-(1-哌嗪基)-3-喹啉甲酸。按干燥品计算,含C17H18FN3O3应为98.5%~102.0%。
4.5 性状
本品为白色至微黄色结晶性粉末;几乎无臭,味苦。
本品在醋酸中溶解,在乙醇和三氯甲烷中极微溶解,在水中几乎不溶。
4.6 鉴别
(1)在含量测定项下记录的色谱图中,供试品溶液主峰的保留时间应与对照品溶液主峰的保留时间一致。
(2)本品的红外光吸收图谱应与对照的图谱(《药品红外光谱集》979图)一致。
4.7 检查
4.7.1 结晶性
取本品少许,依法检查(2010年版药典二部附录Ⅸ D),应符合规定。
4.7.2 溶液的澄清度与颜色
取本品0.1g,加0.1mol/L盐酸10ml溶解后,溶液应澄清无色;如显色,与黄色或黄绿色4号标准比色液(2010年版药典二部附录Ⅸ A)比较,不得更深。
4.7.3 有关物质
取本品约25mg,精密称定,加7%磷酸溶液0.2ml溶解后,用流动相A定量稀释制成每1ml中约含0.5mg的溶液,作为供试品溶液;精密量取适量,用流动相A定量稀释制成每1ml中约含1μg的溶液,作为对照溶液。另精密称取杂质A对照品约15mg,置100ml量瓶中,加6mol/L氨溶液0.6ml与水适量溶解,用水稀释至刻度,摇匀,精密量取1ml,置100ml量瓶中,用流动相A稀释至刻度,摇匀,作为杂质A对照品溶液。照高效液相色谱法(附录Ⅴ D)测定,用十八烷基硅烷键合硅胶为填充剂;流动相A为0.025mol/L磷酸溶液-乙腈(87:13)(用三乙胺调节pH值至3.0±0.1),流动相B为乙腈,按下表进行线性梯度洗脱,流速为每分钟1.5ml。称取氧氟沙星对照品、环丙沙星对照品和杂质Ⅰ对照品各适量,加流动相A溶解并稀释制成每1ml中约含氧氟沙星5μg、环丙沙星0.5mg和杂质Ⅰ 10μg的混合溶液,取20μl注入液相色谱仪,以278nm为检测波长,记录色谱图,环丙沙星峰的保留时间约为12分钟。环丙沙星峰与氧氟沙星峰和杂质Ⅰ峰的分离度均应符合要求。取对照溶液20μl注入液相色谱仪,以278nm为检测波长,调节检测灵敏度,使主成分色谱峰的峰高约为满量程的20%。精密量取供试品溶液、对照溶液和杂质A对照品溶液各20μl,分别注入液相色谱仪,以278nm和262nm为检测波长,记录色谱图,环丙沙星峰的相对保留时间为1,杂质E、杂质B、杂质C、杂质Ⅰ和杂质D峰的相对保留时间分别约为0.3、0.6、0.7、1.1和1.2。供试品溶液色谱图中如有杂质峰,杂质A(262nm检测)按外标法以峰面积计算,不得过0.3%;杂质B、C、D和E(278nm检测)按校正后的峰面积计算(分别乘以校正因子0.7、0.6、1.4和6.7),均不得大于对照溶液主峰面积(0.2%);其他单个杂质(278nm检测)峰面积不得大于对照溶液主峰面积(0.2%),各杂质(278nm检测)校正后峰面积的和不得大于对照溶液主峰面积的2.5倍(0.5%)。供试品溶液色谱图中任何小于对照溶液主峰面积0.1倍的峰可忽略不计。
| 时间(分钟) | 流动相A(%) | 流动相B(%) |
| 0 | 100 | 0 |
| 16 | 100 | 0 |
| 53 | 40 | 60 |
| 54 | 100 | 0 |
| 65 | 100 | 0 |
4.7.4 干燥失重
取本品,以五氧化二磷为干燥剂,在120℃减压干燥6小时,减失重量不得过1.0%(2010年版药典二部附录Ⅷ L)。
4.7.5 炽灼残渣
取本品1.0g,置铂坩埚中,依法检查(2010年版药典二部附录Ⅷ N),遗留残渣不得过0.1%。
4.7.6 重金属
取炽灼残渣项下遗留的残渣,依法检查(2010年版药典二部附录Ⅷ H),含重金属不得过百万分之二十。
4.8 含量测定
照高效液相色谱法(2010年版药典二部附录Ⅴ D)测定。
4.8.1 色谱条件与系统适用性试验
用十八烷基硅烷键合硅胶为填充剂;以0.025mol/L磷酸溶液-乙腈(87:13)(用三乙胺调节pH值至3.0±0.1)为流动相。检测波长为278nm;流速为每分钟1.5ml。称取氧氟沙星对照品、环丙沙星对照品和杂质Ⅰ对照品各适量,加流动相溶解并稀释制成每1ml中约含氧氟沙星5μg、环丙沙星0.1mg和杂质Ⅰ 10μg的混合溶液,取20μl注入液相色谱仪,记录色谱图,环丙沙星峰的保留时间约为12分钟。环丙沙星峰与氧氟沙星峰和杂质Ⅰ峰的分离度均应符合要求。
4.8.2 测定法
取本品约25mg,精密称定,加7%磷酸溶液0.2ml溶解后,用流动相定量稀释制成每1ml中约含0.1mg的溶液,精密量取20μl注入液相色谱仪,记录色谱图;另取环丙沙星对照品,同法测定。按外标法以峰面积计算,即得。
4.9 类别
喹诺酮类抗菌药。
4.10 贮藏
4.11 制剂
4.12 附:
杂质A:1-环丙基-6-氟-7-氯-4-氧代-1,4-二氢喹啉-3-羧酸(氟喹啉酸)
杂质B:1-环丙基-4-氧代-7-(1-哌嗪基)-1,4-二氢喹啉-3-羧酸
杂质C:1-环丙基-6-氟-7-[(2-氨乙基)氨基]-4-氧代-1,4-二氢喹啉-3-羧酸
杂质D:1-环丙基-7-氯-4-氧代-6-(1一哌嗪基)-1,4-二氢喹啉-3-羧酸
杂质E:1-环丙基-6-氟-7-(1-哌嗪基)-4-(1H)喹啉酮
杂质Ⅰ:1-环丙基-7-氯-6-[(2一氨乙基)氨基]-4-氧代-1,4-二氢-3-喹啉甲酸
4.13 版本
《中华人民共和国药典》2010年版
5 环丙沙星介绍
5.1 别名
环丙氟哌酸;奔克;丙氟哌酸;环丙沙星;健美灵;适普灵;特美力; 悉复欢;悉普宁;西普乐;特美力;奎诺仙;
5.2 外文名
Ciprofloxacin , Bay-O-9867, CFLX, Ciproxin, Cifran, Temaril, CPFX
5.3 环丙沙星的适应症
适用于呼吸道、尿道、消化道、胆道、皮肤和软组织、盆腔、眼、耳、鼻、咽喉等部位的感染。
5.4 环丙沙星的用量用法
1.口服:成人1次250mg,1日2次,重症者可加倍量。但1日最高量不可超过1500mg。肾功能不良者(肌酐清除率每分钟低于30ml)应减少服量。
2.静脉滴注:1次100~200mg,1日2次,预先用等渗盐水或葡萄糖注射液稀释,滴注时间不少于30分钟。
5.5 注意事项
1.严重抑制茶碱的正常代谢,联合应用可引起茶碱的严重不良反应,应监测茶碱的血药浓度。对咖啡因,可能对华法林也有同样影响,应予注意。
3.孕妇、授乳妇女和未成年者不宜用本品。
5.6 规格
片剂:每片标示量按环丙氟哌酸计算为250mg、500mg、750mg
注射液:每支100mg