3 国家基本药物
| 序号 | 基本药物目录序号 | 药品名称 | 剂型 | 规格 | 单位 | 零售指导价格 | 类别 | 备注 |
| 302 | 31 | 阿昔洛韦 | 片剂 | 100mg*24 | 盒(瓶) | 6.3元 | 化学药品和生物制品部分 | * |
| 303 | 31 | 阿昔洛韦 | 片剂 | 100mg*20 | 盒(瓶) | 5.3元 | 化学药品和生物制品部分 | |
| 304 | 31 | 阿昔洛韦 | 片剂 | 100mg*30 | 盒(瓶) | 7.8元 | 化学药品和生物制品部分 | |
| 305 | 31 | 阿昔洛韦 | 片剂 | 200mg*10 | 盒(瓶) | 4.6元 | 化学药品和生物制品部分 | |
| 306 | 31 | 阿昔洛韦 | 片剂 | 200mg*20 | 盒(瓶) | 9元 | 化学药品和生物制品部分 | |
| 307 | 31 | 阿昔洛韦 | 片剂 | 200mg*24 | 盒(瓶) | 10.7元 | 化学药品和生物制品部分 | |
| 308 | 31 | 阿昔洛韦 | 片剂 | 200mg*25 | 盒(瓶) | 11.1元 | 化学药品和生物制品部分 | |
| 309 | 31 | 阿昔洛韦 | 片剂 | 200mg*30 | 盒(瓶) | 13.3元 | 化学药品和生物制品部分 | |
| 310 | 31 | 阿昔洛韦 | 胶囊 | 200mg*10 | 盒(瓶) | 5元 | 化学药品和生物制品部分 | |
| 311 | 31 | 阿昔洛韦 | 胶囊 | 200mg*24 | 盒(瓶) | 11.5元 | 化学药品和生物制品部分 | |
| 312 | 31 | 阿昔洛韦 | 分散片 | 100mg*20 | 盒(瓶) | 6.9元 | 化学药品和生物制品部分 | |
| 313 | 31 | 阿昔洛韦 | 分散片 | 100mg*24 | 盒(瓶) | 8.2元 | 化学药品和生物制品部分 | |
| 314 | 31 | 阿昔洛韦 | 分散片 | 200mg*20 | 盒(瓶) | 11.7元 | 化学药品和生物制品部分 | |
| 315 | 31 | 阿昔洛韦 | 乳膏剂 | 300mg:10g | 支 | 2.8元 | 化学药品和生物制品部分 | * |
| 316 | 31 | 阿昔洛韦 | 滴眼剂 | 8mg:8ml | 支 | 4元 | 化学药品和生物制品部分 | * |
| 317 | 31 | 阿昔洛韦 | 滴眼剂 | 5mg:5ml | 支 | 2.6元 | 化学药品和生物制品部分 |
注(化学药品和生物制品部分):
1、表中备注栏标注“*”的为代表品。
2、表中代表剂型规格在备注栏中加注“△”的,该代表剂型规格及与其有明确差比价关系的相关规格的价格为临时价格。
注(中成药部分):
2、表中备注栏加注“△”的剂型规格,及同剂型的其他规格为临时价格。
4 阿昔洛韦药典标准
4.1 品名
4.1.1 中文名
4.1.2 汉语拼音
Axiluowei
4.1.3 英文名
Aciclovir
4.2 结构式
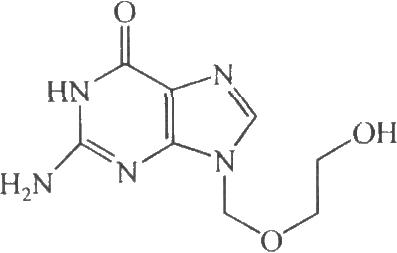
4.3 分子式与分子量
C8H11N5O3 225.21
4.4 来源(名称)、含量(效价)
本品为9-(2-羟乙氧甲基)鸟嘌呤。按干燥品计算,含C8H11N5O3不得少于98.0%。
4.5 性状
本品为白色结晶性粉末;无臭,无味。
本品在冰醋酸或热水中略溶,在乙醚或二氯甲烷中几乎不溶;在氢氧化钠试液中易溶。
4.6 鉴别
(1)在含量测定项下记录的色谱图中,供试品溶液主峰的保留时间应与对照品溶液主峰的保留时间一致。
(2)本品的红外光吸收图谱应与对照的图谱(《药品红外光谱集》213图)一致。
4.7 检查
4.7.1 溶液的澄清度与颜色
取本品0.50g,加1%氢氧化钠溶液10ml使溶解,溶液应澄清无色;如显浑浊,与1号浊度标准液(2010年版药典二部附录Ⅸ B)比较,不得更浓(供注射用)或与2号浊度标准液(2010年版药典二部附录Ⅸ B)比较,不得更浓(供口服、外用);如显色,与黄色1号标准比色液(2010年版药典二部附录Ⅸ A第一法)比较,不得更深(供注射用)或与黄色2号标准比色液(2010年版药典二部附录Ⅸ A第一法)比较,不得更深(供口服、外用)。[1]
4.7.2 有关物质
取本品,加二甲基亚砜溶解并稀释制成每1ml中含10mg的溶液,照薄层色谱法(2010年版药典二部附录Ⅴ B)试验,吸取上述溶液5μl,点于硅胶GF254薄层板上,以三氯甲烷-甲醇-浓氨溶液(80:20:2)为展开剂,展开,晾干,置紫外光灯(254nm)下检视,除主斑点外,不得显其他杂质斑点。
4.7.3 鸟嘌呤与其他有关物质
精密称取本品约40mg,置200ml量瓶中,加0.4%氢氧化钠溶液2ml使溶解,加0.1%(V/V)磷酸溶液25ml后用水稀释至刻度,摇匀,作为供试品溶液;精密量取1ml,置100ml量瓶中,加0.1%磷酸溶液5ml,用水稀释至刻度,摇匀,作为对照溶液;另精密称取鸟嘌呤对照品10mg,置50ml量瓶中,加0.4%氢氧化钠溶液5ml使溶解,加0.1%磷酸溶液5ml,用水稀释至刻度,摇匀,作为鸟嘌呤对照品贮备液;精密量取1ml,置100ml量瓶中,用水稀释至刻度,摇匀,作为鸟嘌呤杂质对照品溶液。照高效液相色谱法(2010年版药典二部附录Ⅴ D)测定,用十八烷基硅烷键合硅胶为填充剂;以水为流动相A,甲醇为流动相B,按下表进行梯度洗脱;柱温35℃;检测波长为254nm。取鸟嘌呤对照品溶液与对照溶液各适量,等体积混合,摇匀,取20μl注入液相色谱仪,调节色谱系统及检测灵敏度,阿昔洛韦峰与鸟嘌呤峰之间的分离度应大于3.0;阿昔洛韦峰的峰高约为满量程的10%。再精密量取供试品溶液、鸟嘌呤对照品溶液与对照溶液各20μl,分别注入液相色谱仪,记录色谱图。供试品溶液色谱图中如有杂质峰,鸟嘌呤的量按外标法以峰面积计算,不得过0.7%;其他各杂质峰面积之和不得大于对照溶液的主峰面积(1.0%)。
| 时间(分钟) | 流动相A(%) | 流动相B(%) |
| 0 | 94 | 6 |
| 15 | 94 | 6 |
| 40 | 65 | 35 |
| 41 | 94 | 6 |
| 51 | 94 | 6 |
4.7.4 干燥失重
取本品,在105℃干燥至恒重,减失重量不得过6.0%(2010年版药典二部附录Ⅷ L)。
4.7.5 炽灼残渣
取本品1.0g,依法检查(2010年版药典二部附录Ⅷ N),遗留残渣不得过0.1%。
4.7.6 重金属
取炽灼残渣项下遗留的残渣,依法检查(2010年版药典二部附录Ⅷ H第二法),含重金属不得过百万分之十。
4.8 含量测定
照高效液相色谱法(2010年版药典二部附录Ⅴ D)测定。
4.8.1 色谱条件与系统适用性试验
用十八烷基硅烷键合硅胶为填充剂;甲醇-水(10:90)为流动相;检测波长为254nm。取阿昔洛韦对照品溶液5ml,加入鸟嘌呤与其他有关物质项下的鸟嘌呤对照品贮备液1ml,摇匀,取20μl注入液相色谱仪,记录色谱图,阿昔洛韦峰与鸟嘌呤峰的分离度应符合要求。
4.8.2 测定法
取本品约50mg,精密称定,置50ml量瓶中,加0.4%氢氧化钠溶液5ml使溶解,用水稀释至刻度,摇匀,精密量取2ml,置100ml量瓶中,用水稀释至刻度,摇匀,精密量取20μl,注入液相色谱仪,记录色谱图;另取阿昔洛韦对照品适量,同法测定。按外标法以峰面积计算,即得。
4.9 类别
抗病毒药。
4.10 贮藏
4.11 制剂
(1)阿昔洛韦片 (2)阿昔洛韦咀嚼片 (3)阿昔洛韦乳膏 (4)阿昔洛韦胶囊 (5)阿昔洛韦滴眼液 (6)阿昔洛韦颗粒 (7)注射用阿昔洛韦
4.12 版本
《中华人民共和国药典》2010年版
5 阿昔洛韦介绍
5.1 别名
阿昔洛韦;开链鸟嘌呤核苷;开糖环鸟苷;舒维疗;无环鸟嘌呤;无环鸟嘌呤核甘 、无环鸟苷、永信克疱、甘泰、建适疗、9-(2-羟乙氧甲基)鸟嘌呤
5.2 外文名
Aciclovir, Aciclor, ACV, Acycloguanosine, BW 248U, Poviral, ZOVIRAX
5.3 阿昔洛韦的适应症
临床应用于防治单纯疱疹病毒HSC1和HSC2的皮肤或粘膜感染,还可用于带状疱疹病毒感染。尚用于治疗乙型肝炎。
5.4 阿昔洛韦的用量用法
1.口服:1次200mg,每4小时1次或1日1g,分次给予。疗程根据病情不同,短则几日,长者可达6个月。肾功能不足者酌减量。
2.静滴:1次每千克体重用量5mg,加入输液中,滴注时间为1小时,每8小时1次,连续7日。12岁以下儿童1次按每平方米体表面积250mg用量给予。对肾功能不足者应减量:肌酐清除率每平方米体表面积每分钟25~50ml者按上量每12小时1次;清除率每平方米体表面积每分钟10~25ml者减为每24小时1次;清除率每平方米体表面积每分钟0~10ml者减为每千克体重2.5mg,每24小时给药1次。国内治疗乙型肝炎的用法为1次滴注每千克体重7.5mg,1日2次,溶于适量输液,维持滴注时间约2小时,连续应用10~30日。
3.治疗生殖器皰疹:1次0.2g,1日4次,连用5~10日。
5.5 注意事项
1.注射给药,只能缓慢滴注(持续1~2小时),不可快速推注,不可用于肌注和皮下注射。
3.不良反应有一时性血清肌酐升高、皮疹、荨麻疹,尚有出汗、血尿、低血压、头痛、恶心等。静脉给药者可有静脉炎。
4.并用丙磺舒,可使本品的排泄减慢,半衰期延长,体内药物易蓄积。
5.6 规格
胶囊剂:每胶囊200mg。注射用阿昔洛维(冻干制剂):每瓶500mg(标示量)
滴眼液:0.1%,8ml/支. 眼膏:3%,3g/支. 霜剂:3%-5%,10g/支. 注射剂:250mg/瓶.
5.7 阿昔洛韦的不良反应
除偶有头晕、呕吐、头痛外,口服阿昔洛韦几乎无毒,静注耐受较好,只1%病人会发生脑病,高剂量静注可引发神经系统障碍。大剂量突击性注射,可发生急性肾小管坏死。其不良反应报告以泌尿系统、神经系统、神经系统和过敏反应等不良反应最多见。
5.8 阿昔洛韦与急性肾功能衰竭
1988年至2006年5月,国家药品不良反应监测中心病例报告数据库中有关阿昔洛韦的病例报告928份。阿昔洛韦不良反应主要表现为恶心、呕吐、腹痛、腹泻、头晕、头痛、泌尿系统损害、肝功能损害、皮疹、过敏样反应等。其中有关泌尿系统损害的病例报告34份:急性肾功能衰竭22例,肾功能异常9例,肾小管损害1例,肾绞痛1例,血尿1例。在泌尿系统损害病例报告中,急性肾功能衰竭占64.71%。
5.9 阿昔洛韦引起急性肾功能衰竭的特点
1、大多数患者既往无药物过敏史,原发疾病基本为面部疱疹,生殖器疱疹等,既往体健,肝、肾功能正常;
2、各年龄均有发病,但老年人、血容量不足、有基础肾脏疾病者更易发生;
3、用药至发生血尿的时间短,可数小时或数天,最长不超过2周,以速发型为主;
4、静脉给药导致急性肾功能衰竭的可能性更大,且与药物剂量、浓度、给药速度有关;
5、发生血尿的同时,部分病例伴有肾外表现,如:腰痛、腰酸、恶心、呕吐等;
6、阿昔洛韦致急性肾功能衰竭的病理特征可表现为急性肾小管坏死或急性间质性肾炎;
7、停药,经积极治疗后大多预后良好,一般不遗留肾功能损害,仅有部分患者留有不同程度的肾功能损害,甚至危及生命。
5.10 建议
鉴于阿昔洛韦引发的急性肾功能衰竭与超出规定的适应症用药、药物剂量过大、浓度过高、给药速度过快、药物配伍不当等因素有关。故提醒临床医生要合理、规范用药,严格掌握用药,特别是静脉用药指征。老年人、孕妇、儿童等高危特殊人群应慎用或在监测下使用。用药时注意给药浓度、速度、分次给药及用药后水化治疗等问题,避免与其它肾毒性药物配伍使用,用药期间应监测尿常规和肾功能。一旦发现异常应立即停药,并尽快明确诊断,及时给予对症治疗。同时建议加强临床合理使用抗病毒药物的教育与宣传,避免此类严重不良反应和药源性疾病的重复发生。
6 化药部颁标准
6.1 拼音名
Axiluowei
6.2 英文名
Aciclovir
6.3 来源
本品为9-(2-羟乙氧甲基)鸟嘌呤。按干燥品计算,含C8H11N5O3不得少于98.0%。
6.4 性状
本品为白色结晶性粉末;无臭,无味。 本品在冰醋酸或热水中略溶,在水中极微溶解,在乙醚或氯仿中几乎不溶,在稀氢 氧化钠溶液中溶解。 吸收系数 取本品,精密称定,加水溶解并稀释成每1ml中约含10μg的溶液,照分 光光度法(中国药典1995年版二部附录Ⅳ A),在252nm的波长处测定吸收度,吸收系 数(E1% 1cm)为603~641。
6.5 鉴别
(1)取本品20mg,置蒸发皿中,加盐酸2ml,置水浴上蒸干,再加盐酸1ml 与氯酸钾约30mg,置水浴上蒸干,冷却,于残渣中滴加氨试液2~3滴,残渣显紫红色。 再加氢氧化钠试液数滴,紫红色消失。
(2)取本品加水溶解并制成每1ml中含10μg的溶液,照分光光度法(中国药典1995年 版二部附录Ⅳ A)测定,在252nm的波长处有最大吸收;220nm的波长处有最小吸收。
(3)本品的红外光吸收图谱与对照的图谱(药品红外光谱集1995年版213图)一致。
6.6 检查
溶液的澄清度与颜色 取本品0. 5g,研细,加0.4%氢氧化钠溶液10ml, 溶解后,溶液应澄清无色;如显浑浊,与2号浊度标准液(中国药典1995年版二部附录Ⅸ B)比较,不得更浓;如显色,与黄色2号标准比色液(中国药典1995年版二部附录Ⅸ A 第一法)比较,不得更深。 有关物质 取本品,加二甲基亚砜制成每1ml中含10mg的溶液,照薄层色谱法(中国 药典1995年版二部附录Ⅴ B)试验,吸取上述溶液5μl,点于硅胶GF254薄层板上,以 氯仿-甲醇-氨水(80:20:2)为展开剂,展开后,晾干,置紫外光灯(254nm)下检视,除 主斑点外,不得显其他斑点。 鸟嘌呤 取本品约50mg,精密称定,置50ml量瓶中,加0.4%氢氧化钠溶液5ml使溶 解,用水稀释至刻度,摇匀,精密量取10ml,置50ml量瓶中,用水稀释至刻度,摇匀, 作为供试品溶液;另取鸟嘌呤对照品10mg,置100ml量瓶中,加0.4%氢氧化钠溶液适量 使溶解,并稀释至刻度,摇匀,精密量取2ml,置100ml量瓶中,用水稀释至刻度,摇匀, 作为对照品溶液。用含量测定项下的方法和溶液,取20μl注入液相色谱仪,调节检测灵 敏度,使主成分色谱峰达记录仪的满标度,再分别取供试品溶液和对照品溶液各20μl, 分别注入液相色谱仪,记录色谱图,供试品溶液中鸟嘌呤色谱峰的峰面积不得大于鸟嘌 呤对照品溶液峰面积。 干燥失重 取本品,在105℃干燥至恒重,减失重量不得过6.0%(中国药典1995年版 二部附录Ⅷ L)。 炽灼残渣 取本品1. 0g,依法检查,遗留残渣不得过0.1%(中国药典1995年版二部 附录Ⅷ N)。 重金属 取炽灼残渣项下遗留的残渣,依法检查(中国药典1995年版二部附录ⅧH 第二法),含重金属不得过百万分之十。
6.7 含量测定
照高效液相色谱法(中国药典1995年版二部附录Ⅴ D)测定。 色谱条件与系统适用性试验 用十八烷基硅烷键合硅胶为填充剂;甲醇-水(10:90) 为流动相;检测波长为254nm。理论板数按阿昔洛韦峰计算,应不低于2000。 测定法 取本品约50mg,精密称定,置50ml量瓶中,加0.4%氢氧化钠溶液5ml使溶 解,用水稀释至刻度,摇匀,精密量取2ml,置100ml量瓶中,用水稀释至刻度,摇匀, 精密量取20μl注入液相色谱仪,记录色谱图;另精密称取阿昔洛韦对照品,同法测定, 按外标法以峰面积计算。
6.8 作用与用途
6.9 用法与用量
口服 一次0.1~0. 2g 一日0.5~ 1g
6.10 贮藏
6.11 制剂
(1)阿昔洛韦片
(2)阿昔洛韦软膏
(3)阿昔洛韦眼膏
(4)阿昔洛韦滴 眼液
(5)注射用阿昔洛韦
7 参考资料
- ^ [1] 国家药典委员会.中华人民共和国药典:2010年版:第二增补本[M].北京:中国医药科技出版社,2010.