1 拼音
zhí cháng ái guī fàn huà zhěn liáo zhǐ nán (shì xíng )
《直腸癌規範化診療指南(試行)》由國家衛生和計劃生育委員會於2013年4月23日衛辦醫管發〔2013〕33號印發。
直腸癌規範化診療指南(試行)
3 2 術語和定義
下列術語和定義適用於本指南。
直腸系膜:指的是在中下段直腸的後方和兩側包裹着的,形成半圓,厚1.5~2.0cm的結締組織,內含有動脈、靜脈、淋巴組織及大量脂肪組織,上自第3骶椎前方,下達盆膈。
6 5 診斷依據
6.1 5.1 病因
6.1.1 5.1.1 環境因素
6.1.2 5.1.2 內在因素
6.2 5.2 高危人羣
5.2.4 有大腸癌病史者。
5.2.9 有盆腔放射治療史者。
6.3 5.3 臨牀表現及體徵
6.3.1 5.3.1 症狀
主要表現爲直腸刺激症狀:便頻、裏急後重、肛門下墜、便不盡感、肛門痛等。大便表面帶血和/或粘液,嚴重時有膿血便。根據臨牀表現出現的頻度,直腸癌臨牀表現依次以便血、便頻及大便變形多見。
6.3.2 5.3.2 直腸指診
凡遇到患者有便血、直腸刺激症狀、大便變形等症狀均應行直腸指診。檢查時動作要輕柔,切忌粗暴,要注意有無腫物觸及,腫瘤距肛門距離、大小、硬度、活動度、粘膜是否光滑、有無壓痛及與周圍組織關係、是否侵犯骶前組織。如果腫瘤位於前壁,男性必須明確與前列腺關係,女性患者需做陰道指診,查明是否侵犯陰道後壁。指診檢查完畢應觀察指套有無血跡。
6.4 5.4 輔助檢查
6.4.1 5.4.1 內鏡檢查
內鏡檢查是診斷直腸癌最安全、有效的檢查方法。內鏡檢查可直接觀察病竈,並取活體組織做病理診斷。取活檢時需注意取材部位,做多點取材。如果活檢陰性且臨牀考慮爲腫瘤的患者,應重複取材以免漏診。
6.4.2 5.4.2 X線檢查
氣鋇雙重對比造影X線攝片檢查表現有:①結節狀充盈缺損,多在直腸的內側壁,圓形光滑或輕度分葉,局部腸壁僵硬,凹入;②菜花狀腫塊,較大,表面不平,分葉明顯,其底寬,腸壁僵硬;③不規則的環狀狹窄,管壁僵硬,粘膜中斷,分界截然;④不規則的腔內龕影,呈三角形、長條形等,較淺,周圍環堤寬窄不均;⑤完全性腸梗阻,或腸套疊徵象,阻塞近段有時難以顯示。
應注意,鋇灌腸的X線檢查有時無法顯示直腸病變,易讓人產生無病變的錯覺。
6.4.3 5.4.3 B型超聲波檢查
腹部B型超聲掃描對判斷肝臟有無轉移有一定價值,應列爲術前常規檢查內容。
6.4.4 5.4.4 CT掃描檢查
腹盆腔增強CT檢查應爲常規檢查項目,對於術前瞭解肝內有無轉移,腹主動脈旁淋巴結是否腫大,癌腫對周圍結構或器官有無浸潤,判斷手術切除的可能性和危險性等,指導術前選擇合理的治療方案提供可靠依據。
6.4.5 5.4.5 胸部X射線攝影檢查
應包括胸部正位和側位片,排除肺轉移。對於胸部X線檢查異常者行胸部CT檢查除外轉移。
6.4.6 5.4.6 盆腔MRI檢查
MRI具有較高的對比分辨率,可清楚顯示盆腔內軟組織結構和臟器毗鄰關係,對直腸癌的術前分期和指導手術方案選擇有重要作用。
6.4.7 5.4.7 實驗室檢查
血常規、尿常規、大便常規+大便潛血試驗,血型,肝功能、腎功能,凝血功能,血糖,電解質,血清病毒指標檢測,腫瘤標誌物檢查(CEA和CA19-9)。
6.4.8 5.4.8 心電圖檢查
7 6 直腸癌的分類和分期
7.1 6.1 直腸腫瘤的組織學分類


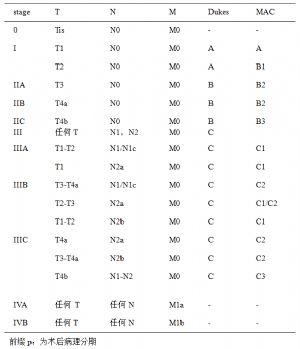
7.2 6.2 直腸癌的分期
7.2.1 6.2.1 Dukes分期
由於1932年Dukes提出的直腸癌分期簡單易行,且對預後有一定的指導意義,因此,目前仍被應用。
直腸癌Dukes分期
DukesA期:腫瘤侷限於腸壁內;
DukesB期:腫瘤侵犯至腸壁外;
7.2.2 6.2.2 TNM分期
美國癌症聯合協會(AJCC)提出的TNM分期系統對直腸癌的預後有更好的指導意義。
表2 TNM分期(AJCC, 2009 第七版)
T-原發瘤分期
T0 無原發腫瘤證據
Tis 原位癌:上皮內或粘膜固有層
T1 腫瘤侵犯粘膜下層
T2 腫瘤侵犯固有肌層
N – 區域淋巴結
Nx 區域淋巴結不能評價
-N1c 無區域淋巴結轉移,但在漿膜下或無腹膜被覆的結腸或直腸旁組織存在單個(或多個)癌結節(衛星竈)
M- 遠處轉移
M0 無遠處轉移
M1 有遠處轉移
-M1a 單個器官或部位發生轉移(如肝、肺、卵巢、非區域淋巴結,如髂外和髂總淋巴結)
TNM分期及Dukes分期
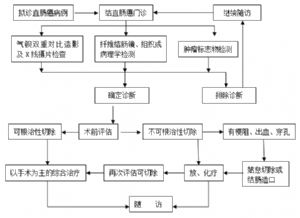
8 7 診斷和鑑別診斷
8.1 7.1 診斷
年齡在40歲以上,有以下任一表現者應列爲高危人羣:①Ⅰ級親屬有直腸癌病史者;②有癌症史或腸道腺瘤或息肉史者;③大便隱血試驗陽性者;④以下五種表現中具有2項以上者:粘液血便、慢性腹瀉、慢性便祕、慢性闌尾炎史及精神創傷史。對此高危人羣行腸鏡檢查或氣鋇雙重對比灌腸造影X線攝片檢查可明確診斷。
8.2 7.2 鑑別診斷
對有便血、便頻、便細、粘液便等症狀的患者予以高度警惕,必須進一步檢查,排除直腸癌的可能性。通過直腸指診、內鏡檢查及病理檢查明確診斷。
9 8 治療
9.1 8.1 治療原則
臨牀上一般應採取以手術爲主的綜合治療。根據病人的全身狀況和各個臟器功能狀況、腫瘤的位置、腫瘤的臨牀分期、病理類型及生物學行爲等決定治療措施。合理地利用現有治療手段,以期最大程度地根治腫瘤、最大程度地保護臟器功能和改善病人的生活質量。直腸癌的治療主要有手術治療、放射治療和化學治療及靶向治療。
9.2 8.2 手術治療
9.2.1 8.2.1 手術治療適應證
8.2.1.1全身狀態和各臟器功能可耐受手術。
8.2.1.2腫瘤侷限於腸壁或侵犯周圍臟器,但可整塊切除,區域淋巴結能完整清掃。
8.2.1.3已有遠處轉移(如肝轉移、卵巢轉移、肺轉移等),但可全部切除,酌情同期或分期切除轉移竈。
8.2.1.4廣泛侵襲或遠處轉移,但伴有梗阻、大出血、穿孔等症狀應選擇姑息性手術,爲下一步治療創造條件。
9.2.2 8.2.2 手術治療禁忌證
8.2.2.2廣泛遠處轉移和外侵,無法完整切除,無梗阻、穿孔、大出血等嚴重併發症。
9.2.3 8.2.3 手術治療方法的選擇
8.2.3.1 直腸癌局部切除手術需嚴格把握以下手術指徵①腫瘤侵犯腸周徑<30%;②腫瘤大小<3cm;③切緣陰性(距離腫瘤>3mm);④腫瘤活動,不固定;⑤腫瘤距肛緣8cm 以內;⑥僅適用於T1N0M0腫瘤;⑦內鏡下切除的息肉,伴癌浸潤,或病理學不確定;⑧無血管淋巴管浸潤(LVI)或神經浸潤;⑨高-中分化;⑩治療前影像學檢查無淋巴結腫大的證據。
注:局部切除標本必須由手術醫師展平、固定,標記方位後送病理檢查。
術後病理如果爲T2或者T1伴有切緣陽性、血管淋巴管侵潤、分化差的高危患者則應行經腹切除術。拒絕手術患者考慮放射治療。
8.2.3.2 經腹直腸癌根治性切除術 全直腸系膜切除術(TME)爲中低位直腸癌手術的標準術式,是指在直視下銳性解剖盆筋膜髒層和壁層間的特定間隙,完整切除髒層筋膜內的全部組織,包括直腸系膜內的血管淋巴管結構、脂肪組織和直腸系膜筋膜,保留自主神經功能。切除腫瘤下緣以下4~5cm的直腸系膜或達盆膈,下段直腸癌(距離肛緣小於5cm)切除腫瘤遠端腸管至少2cm。
9.2.4 8.2.4 手術方式
直腸癌低位前切除術、經腹會陰聯合切除術、Hartmann手術等。
9.2.5 8.2.5 轉移竈的處理
8.2.5.1肝轉移 完整切除必需考慮腫瘤範圍和解剖學上的可行性。切除後剩餘肝臟必須能夠維持足夠功能。達不到R0切除的減瘤手術不做推薦,無肝外不可切除病竈。不可切除的病竈經化療後需重新評價切除可行性。當所有已知病竈均可作消融處理時方可考慮應用消融技術。全身化療無效或化療期間肝轉移進展,可行肝動脈灌注化療及化療栓塞術治療,不應常規應用。當原發竈必須能根治性切除或已得到根治性切除時,某些患者可考慮多次切除。
8.2.5.2 肺轉移 完整切除必須考慮腫瘤範圍和解剖部位,肺切除後必須能夠維持足夠功能。有肺外可切除病竈並不妨礙肺轉移瘤的切除。當原發竈必須能根治性切除或已得到完整切除時,某些患者可考慮多次切除。
9.3 8.3 放射治療(不具備放療條件轉上級醫院)
放射治療主要用於可手術直腸癌患者的術前術後輔助治療,不可手術的局部晚期直腸癌患者的綜合治療,以及晚期直腸癌的姑息減症治療。
9.3.1 8.3.1 直腸癌放射治療原則
①採用5-氟尿嘧啶基礎之上的同步放化療;②放療可採用三維適形放療或常規照射技術;③術後輔助治療病例在術後4周,身體基本恢復後進行;④術前放化療病例應在明確病理診斷後進行。
9.3.2 8.3.2 直腸癌分期治療模式
①I期(T1-2N0M0)經肛切除術後,如果爲T1存在高風險因素(分化差、脈管淋巴管受侵、切緣陽性)或T2病例應給予術後同步放化療;②II、III期(T3-4N0M0,T1-4N1-2M0)的標準治療爲術前同步放化療或術後同步放化療;③T4或N2病例術前同步放化療對提高手術切除率和局部控制率更有優勢,低位直腸癌通過術前同步放化療能提高保肛率;④IV期(T1-4N0-2M1),可手術切除的晚期直腸癌(侷限於肝或肺的轉移竈以及盆腔原發竈可手術切除),如果病理分期爲T1-4N1-2M1,建議術後輔助化療後行盆腔同步放化療;⑤術後局部復發可再次手術切除病例,如果再分期爲II、III期(T3-4N0M0,T1-4N1-2M0),且既往未曾接受放療,建議術後同步放化療。不能手術切除的、復發後無法手術切除的、或高齡、合併嚴重併發症無法手術的直腸癌,進行同步放化療,緩解症狀,提高生存質量並延長生存時間,部分病例轉爲手術切除;⑥如果術中發現腫瘤無法手術切除或無法手術切淨時,可考慮術後同步放化療;⑦骨或其他部位轉移竈引起疼痛,嚴重影響患者生活質量時,如果病人身體狀況允許,可考慮局部放療以減輕病人症狀,改善生活質量。
9.4 8.4 化學治療
9.4.1 8.4.1 輔助化療
8.4.1.1輔助化療的適應症
II及III期直腸癌術後均推薦輔助化療。
8.4.1.2 輔助化療方案
5-FU/CF;
卡培他濱單藥;
奧沙利鉑+5-FU/CF;
奧沙利鉑+卡培他濱;
不推薦伊立替康作爲直腸癌術後的輔助治療。
8.4.1.3 輔助化療的時間
目前推薦直腸癌術後輔助化療的時間爲6個月。
9.4.2 8.4.2 轉移性直腸癌的全身化療
化療可以延長轉移性直腸癌患者的生存時間,提高生活質量,並可使部分無法手術切除的轉移竈轉變爲可手術切除。
直腸癌化療最常用的藥物包括氟尿嘧啶類化合物(5-氟尿嘧啶和卡培他濱)、奧沙利鉑和伊立替康。氟尿嘧啶類藥物往往與奧沙利鉑或伊立替康組成聯合方案應用。奧沙利鉑和伊立替康治療轉移性直腸癌的療效相近,與氟尿嘧啶聯合的有效率30%-50%。但兩者的不良反應不同,奧沙利鉑的劑量限制性毒性是外周神經毒性,而伊立替康的劑量限制性毒性是遲發性腹瀉和中性粒細胞減少。
對於一般狀況良好(ECOG 0-1)的患者,一線化療可選擇奧沙利鉑或伊立替康聯合氟尿嘧啶類藥物。二線化療可選擇一線未用過的藥物。對於ECOG評分爲2的患者,可採用5-FU或卡培他濱單藥化療。對於一般情況較差(ECOG評分≥3)者可給與最佳支持治療(BSC),包括緩解疼痛、營養支持等。
10 9 隨訪
對治療後的直腸癌病人進行定期複查和隨訪。術後前2年內每3個月複查1次,以後每6個月1次,至5年;5年之後每年1次,並進行詳細問診和體格檢查,肝臟B 超及CEA等腫瘤標誌物檢測。高危復發病人可考慮每年1次胸腹盆增強CT檢查(共3年)。術後1年內行腸鏡檢查,若無異常,每3年時再複查1次;如果術前因腫瘤梗阻無法行全結腸鏡檢查,術後3~6個月內行腸鏡檢查。低位前切除者5年內每6個月進行1次直腸鏡檢查。
11 附錄1 直腸癌手術後病理描述(模板)
1、描述記錄
切除 腸一段,總長 釐米,距一側切緣 釐米,距另一側切緣 釐米處見 型(包括外觀描寫)腫物(單發/多發數目/家族性息肉病需要記述平方釐米息肉數目):大小--×--×--釐米,切面性狀 ; 浸潤深度至 。腫物旁或腫物周圍腸管粘膜/肌壁內檢查所見(息肉/腺瘤/潰瘍性結腸炎/必要的陰性所見)。腸壁找到淋巴結(數/多/十餘/數十餘)枚,直徑 至 釐米;腸繫膜找到淋巴結(數/多/十餘/數十餘)枚,直徑 至 釐米;腸繫膜根部(臨牀系線處)是否找到腫大淋巴結。
2、Miles手術/ 直腸
切除腸管總長 釐米,肛管長 釐米,距上切緣 釐米,距齒狀線 釐米處見 型(包括外觀描寫)腫物:大小---×---×---釐米,浸潤深度至 ,是否侵及齒狀線,切面性狀。腫物周圍腸管粘膜/肌壁內檢查所見(息肉/腺瘤/必要的陰性所見)。腸壁找到淋巴結(數/多/十餘/數十餘)枚,直徑 至 釐米;腸繫膜找到淋巴結(數/多/十餘/數十餘)枚,直徑 至 釐米。肛管皮膚情況。
12 附錄2 直腸癌手術後病理診斷報告內容
1、腫瘤
(1) 組織分型
(2) 組織分級
(3) 浸潤深度
(7) 腸周膿腫形成
2、切緣
(1)近端
(2)遠端
(3)基底切緣(直腸)
3、其他病理所見
(1)總數
(2)受累的數目
5、遠處轉移
8、有困難的病理提交上級醫院會診(提供原始病理報告以覈對送檢切片的正確,從而減少誤差,提供充分的病變切片或蠟塊,以及術中所見等)。
13 參考文獻
1、董志偉,谷銑之。臨牀腫瘤學。北京:人民衛生出版社,2002:935-954。
2、NCCN. Rectal cancer clinical practice guidelines in oncologyv.3.2013.
3、Edge SBB, D.R.; Compton, C.C.; Fritz, A.G.; Greene, F.L.; Trotti,A. AJCC Cancer Staging Manual (ed 7thEditoin). New York: Springer; 2010.