1 拼音
jiē chù jìng hù lǐ chǎn pǐn zhù cè jì shù shěn chá zhǐ dǎo yuán zé
《接觸鏡護理產品註冊技術審查指導原則》由國家食品藥品監督管理局於2011年3月24日食藥監辦械函[2011]116號印發。
2 一、前言
接觸鏡護理產品用於對接觸鏡進行科學的護理與保養,以維持接觸鏡功能,並保障使用者安全、舒適與順利配戴。
本指導原則系對接觸鏡護理產品的一般要求,申請人/生產企業應依據具體產品的特性對註冊申報資料的內容進行充實和細化,並依據具體產品的特性確定其中的具體內容是否適用。
本指導原則是對申請人/生產企業和審查人員的指導性文件,但不包括註冊審批所涉及的行政事項,亦不作爲法規強制執行,如果有能夠滿足相關法規要求的其他方法,需要提供詳細的研究資料和驗證資料。應在遵循相關法規的前提下使用本指導原則。
本指導原則是在現行法規和標準體系以及當前認知水平下制定的,隨着法規和標準的不斷完善,以及科學技術的不斷髮展,本指導原則相關內容也將進行調整。
3 二、適用範圍
本指導原則適用於指導接觸鏡護理產品註冊申報資料的準備,同時也爲食品藥品監管部門對申報資料的審評提供技術參考。
本指導原則是針對接觸鏡片的護理產品,適用於各類具有接觸鏡的清潔、消毒、沖洗、浸泡、保存、潤滑等之一或以上作用的護理產品。目前主要包括了專用於接觸鏡護理的生理鹽水、清潔劑、接觸鏡化學消毒產品、多功能液、配戴接觸鏡中應用的潤滑液。
4 三、註冊申報資料要求
4.1 (一)產品的技術資料(適用於首次註冊)
技術報告是申報資料的基礎,通過技術報告可以詳細迅速地瞭解產品概況,包括產品的研發思路、生產過程、各項性能指標的確定依據等重要內容,爲產品設計的合理性、產品安全性提供初步判斷的依據。接觸鏡護理產品申請人/生產企業對研發接觸鏡的便捷護理程序應慎重考慮。
接觸鏡護理產品的技術報告應該包括法規對技術報告的通用要求內容,重點關注產品活性成分,但是在評估產品活性成分的同時,還應該評估產品的非活性成分(例如:緩衝液)帶來的影響。評估因素包括:接觸鏡護理產品與鏡片的相容性、生物相容性、主要有效成分(其中表面活性劑濃度可由臨界膠束濃度替代)、抗微生物活性、防腐有效性、無菌性、pH值、溶液滲透壓等。在此基礎上重點體現如下信息並提供相關支持信息描述的技術資料:
1.基本信息:
(2)各護理產品的用途,其適用的接觸鏡材料類型(具體參照國家標準)的描述。
(3)護理產品使用方法的描述。對每種護理產品的使用步驟應有詳細的描述。
(4)國內外同類產品動態分析:提供申報產品與類似產品的組分對比數據。
2.明確產品的配方、各組分對應功能。提供產品原材料的信息(如材料來源、質量控制標準等)。申請人/生產企業應提交相關資料以說明各組分的安全性、有效性,如組分特徵數據和/或用於臨牀試驗產品批次的有關分析結果,材料安全性數據表等。如果組成成分符合中華人民共和國藥典, 或醫療器械國家標準和行業標準的規定,應有相應說明。如果組成成分包含藥物成分或動物源性的原材料應參照相應指導原則提交資料。
3.對製造過程進行相應描述,包括流程圖。介紹產品生產過程,包括各種加工工藝(註明關鍵工藝及參數),提供產品生產過程的確定依據以及涉及到的研究性資料、文獻資料。
4.描述產品採用的包裝容器材料和規格,是否採取了合理的保護措施,防止使用中的污染。採用的產品包裝容器材料應通過毒理學評價試驗,提供其質量控制標準及選擇包裝容器材料的安全性證明資料。
5.無菌:對以無菌方式提供的接觸鏡護理產品,申請人/生產企業需要對用於保證產品無菌的質量保證體系和滅菌方法進行描述並提供相應驗證資料。如果滅菌過程使用了環氧乙烷(EO),必須提供產品或產品包裝的EO最大殘留量的驗證資料。
6.微生物限度檢驗:對以非無菌方式提供的接觸鏡護理產品,申請人/生產企業需要提供微生物限度檢查數據,以保證產品符合YY0719.2《眼科光學接觸鏡護理產品 第2部分:基本要求》中微生物的要求。
8.防腐有效性:含有防腐劑的護理產品,申請人/生產企業必須提供產品在有效期內的防腐有效性的驗證資料。
9.開封產品拋棄日期:含有防腐劑的護理產品,申請人/生產企業必須提供產品開封拋棄日期的驗證資料。
10.提供產品有效期(穩定性)驗證數據:申請人/生產企業在申報產品註冊時需要提供產品有效期的驗證報告(包括:涉及產品性能穩定與無菌持續狀態的保證期限)及內包裝材料信息。
11.在推薦護理方案下的溶液與接觸鏡鏡片相容性:鏡片的類型可表明產品的特定用途,對不同類型的鏡片與護理液的相容性需要進行評估。
12.防腐劑的吸收/釋放:如果接觸鏡用護理液中含有防腐劑,需要提供防腐劑吸收/釋放的技術資料。尤其在產品含有在護理產品中未使用過的防腐劑時,申請人/生產企業需要評估非活性成分(例如緩沖劑等)對防腐劑吸收/釋放的影響。
4.2 (二)產品的風險管理資料
根據YY/T0316《醫療器械風險管理對醫療器械的應用》,對接觸鏡護理產品的原材料、生產加工過程、產品包裝、滅菌、運輸、貯存、使用等產品壽命週期的各個環節,從能量危害(若涉及)、生物學危害、環境危害、有關使用的危害、由功能失效和維護及產品老化引起的危害等方面,進行風險分析,詳述所採取的風險控制措施。
4.3 (三)註冊產品標準
根據《醫療器械標準管理辦法》(試行)的要求,註冊產品標準應符合國家標準、行業標準和有關法律、法規的要求。在此基礎上,生產企業應根據產品的特點,參照《無源植入性醫療器械產品註冊申報資料指導原則》相關要求制定保證產品安全有效、質量可控的技術要求。註冊產品標準中技術要求及試驗方法均應經過相應驗證。
4.4 (四)產品的註冊檢測
一般情況下根據產品的穩定性(可參考YY0117.6《眼科光學接觸鏡護理產品 第6部分:有效期測定指南》),選擇風險最大的產品規格(可不侷限於一種規格)進行註冊檢測,如同一產品不同規格的有效期不同,則應分別送檢。
4.5 (五)產品的臨牀試驗資料
對於按照《醫療器械註冊管理辦法》規定需要在國內進行臨牀試驗的註冊申報項目,臨牀試驗應符合國家食品藥品監督管理局頒佈的《醫療器械臨牀試驗規定》及其他相關法律、法規的規定,同時參考本指導原則制定臨牀試驗方案並實施。
接觸鏡護理產品的臨牀資料應評價和確認接觸鏡護理產品的臨牀安全性、有效性;研究接觸鏡護理產品對所適用類型接觸鏡鏡片是否達到安全有效的護理和保養,護理產品與鏡片的相容性以及對眼部產生的影響;針對接觸鏡護理產品新開發的功能進行臨牀試驗觀察。
1.適用範圍
適用於接觸鏡的清潔、消毒、沖洗、浸泡、保存等。適用的接觸鏡種類及護理產品功能應根據具體申報產品特點進行明確規定。
2.臨牀試驗方案
臨牀試驗方案設計中應重點考慮以下方面:
(1)設置合理對照組
目前凡在我國申請上市、按法規需要進行臨牀試驗的接觸鏡護理產品,進行臨牀試驗時均應設立對照組,對照產品應是我國已經批准上市的同類產品,對照組與試驗組的適用鏡片應相同。對於臨牀上無同類產品的創新型產品,應採用臨牀常規的鏡片護理產品及方法作爲對照。
(2) 臨牀試驗病例數(樣本量)評價
接觸鏡護理產品的有效性、安全性的評估均應採用臨牀上通用的評價標準。臨牀試驗持續時間須不少於3個月,每個評價病例應該是完整的雙眼數據,臨牀試驗最終完成總樣本量不少於120例,按1:1設置對照,試驗組不少於60例。根據現行《醫療器械臨牀試驗規定》,臨牀試驗應當在兩家以上(含兩家)醫療機構進行。
3.試驗組和對照組需採用統一的入選標準和排除標準,其標準的具體內容由臨牀試驗負責單位具體討論決定。
4.臨牀試驗觀察項目及常規療效評價指標
(1)屈光狀態:裸眼視力、最佳矯正視力、屈光度。其中視力可利用我國標準對數視力表檢查志願者的裸眼及各種矯正遠視力、近視力並進行記錄(小數或對數)。應提供受試者戴鏡前、後的屈光度變化(球鏡度及柱鏡度)。
(2)眼部情況:在臨牀試驗期間要求定期隨訪觀察眼部的變化,包括:淚液膜、結膜、角膜、前房、晶狀體、眼底、眼壓等,在試驗期間需嚴密監控並記錄臨牀併發症的發生,隨訪次數由試驗負責單位設計確定,原則上不能少於三次。
(3)接觸鏡配適狀態:初次配戴及定期隨訪中需觀察鏡片在眼表的位置(中心定位)、鬆緊度、活動度、熒光染色(硬性透氣性接觸鏡適用),並評價與記錄其等級。
(4)測試護理液和鏡片:定期隨訪中觀察鏡片的污損情況,觀察鏡片有無沉澱、變形、變色、鏽斑、劃痕、破損等,護理液有無混濁、雜質、沉澱等。
(5)安全性評價:
① 受試者的眼部不良反應
② 醫生診斷的眼部併發症
③ 鏡片的異常改變
目前接觸鏡護理產品的臨牀常規療效評價指標可參見附錄Ⅰ和附錄Ⅱ。
5.隨訪時間點及方法
分別於使用後1周、1個月、3個月進行隨訪(結合試驗具體情況可設定更爲頻繁的觀察時間),在隨訪中對接觸鏡護理產品的有效性、安全性、舒適性等方面進行評估(隨訪內容可參見附錄Ⅲ)。
6.臨牀試驗報告
(1) 臨牀試驗報告內容應與臨牀試驗方案內容保持一致,尤其注意明確以下內容:試驗產品的產品名稱、規格型號及所對應的試驗病種和各個病種的病例數;試驗產品的臨牀適用範圍/適應症、禁忌症與注意事項。
(2) 臨牀試驗報告中應明確失訪例數及失訪原因。
(3) 臨牀試驗報告中需報告所有不良事件和不良反應發生的時間、發生的原因、結果及與試驗用品的關係。對於所採取的措施及受試者的愈後需予以明確記錄說明。
(4)臨牀試驗報告中應明確臨牀試驗結論。
4.6 (六)產品質量跟蹤報告(適用於重新註冊)
1.爲全面瞭解已註冊產品臨牀使用情況,申請人/生產企業應在質量跟蹤報告中提供已註冊產品市場銷售情況,包括產品銷售量;如果產品型號間差異較大時,應提供不同型號產品銷售情況。
2.根據產品臨牀適用範圍/適應症,詳述產品上市後臨牀隨訪情況。
3.詳述產品上市後所有不良事件、投訴發生情況,對不良事件、投訴原因分析與處理情況。
4.爲了對重新註冊產品的安全性和有效性做出科學合理的評價,申請人/生產企業應詳細說明此次申請重新註冊產品與原註冊產品相比的任何變化情況。可能涉及但不限於以下幾個方面:
(1)材料及材料供應商
(2)加工工藝
(3)產品配方
(4)適用範圍/適應症
(5)包裝材料
(6)滅菌方式
(7)使用方法
若存在任何一種涉及產品技術性的變化,則申請人/生產企業需要提交該變化是否會帶來新風險的詳細論證資料。
4.7 (七)產品介紹、標籤和包裝標識
根據《醫療器械介紹、標籤和包裝標識管理規定》的要求提供產品介紹,此外還應注意以下內容:
1.包裝
應符合GB19192《隱形眼鏡護理液衛生要求》第7款和YY0719.2 《眼科光學 接觸鏡護理產品 第2部分:基本要求》第14款的要求,包裝應具完整性和密封性。
2.介紹和標籤
從所有接觸鏡配戴者的切身利益出發,爲了更好的促使配戴者按規範程序進行安全護理,保證眼部健康衛生,接觸鏡護理產品的使用說明書/標籤應突出強調接觸鏡護理的重要性,爲接觸鏡的正確護理提供具體指導。
(1)標籤和介紹
應符合GB19192《隱形眼鏡護理液衛生要求》第7款要求和YY0719.2《眼科光學 接觸鏡護理產品 第2部分:基本要求》第16款的要求。
(2)介紹中應告知配戴者,由專業眼科醫師和專業技術人員確定配戴者是否適宜驗配接觸鏡並使用相應護理產品。同時應明確告知配戴者一旦出現眼部不適情況,應立即停止使用並及時就診。
(3)告知驗配者驗配前需認真詢問病史,詳細進行眼部檢查、醫學驗光,結合每個人的個體情況、生活及工作環境條件,確定接觸鏡處方及護理產品。驗配後詳細爲配戴者講解鏡片及護理產品的使用方法,鏡片清潔護理的原則、方法,指導其摘、戴鏡片,並強調戴鏡及使用護理產品的注意事項、定期隨訪的重要性,制定定期複查計劃。
(4)考慮到可能存在的污染物問題、使用者不合理使用或易混淆的問題,接觸鏡多功能護理液的介紹不能標註此類產品爲眼內使用溶液或可在接觸鏡配戴時潤滑和/或溼潤鏡片。
(5)目前,對於接觸鏡護理產品中的接觸鏡多功能護理液,不建議申請人/生產企業在介紹中宣傳免揉搓功能,而應在介紹中特別增加要認真揉搓鏡片的提示,重點強調使用多功能護理液揉搓和沖洗接觸鏡是一種有效的鏡片護理方式,能夠明顯減少微生物感染的危害。
5 四、名詞解釋
1.接觸鏡(contact lens):設計用於配戴眼球前表面的眼科鏡片。
2.臨界膠束濃度(critical micelle concentration):表面活性劑分子在溶劑中絡合形成膠束的最低濃度即爲臨界膠束濃度。
3.活性成分(active ingredient):又稱有效成分,指能使接觸鏡護理產品達到預期目的配方中的化學成分(如:抗微生物劑、防腐劑、酶、表面活性劑、保溼劑等)。
6 五、參考文獻
1.《醫療器械監督管理條例》(中華人民共和國國務院令第276號)
2.《醫療器械註冊管理辦法》(國家食品藥品監督管理局令第16號)
3.《醫療器械臨牀試驗規定》(國家食品藥品監督管理局令第5號)
4.《醫療器械介紹、標籤和包裝標識管理規定》(國家食品藥品監督管理局令第10號)
5.YY/T0316-2003《醫療器械 風險管理對醫療器械的應用》
6.FDA,Guidance Document for contact lens care products, 2006.11
7.ISO 11980:1997 Ophthalmic optics— Contact lenses and contact lens care products— Guidance for clinical investigations
8.YY0719.1-2009《眼科光學 接觸鏡護理產品 第1部分:術語》
9.YY0719.2-2009《眼科光學 接觸鏡護理產品 第2部分:基本要求》
10.YY0719.3-2009《眼科光學 接觸鏡護理產品 第3部分:微生物要求和試驗方法及接觸鏡護理系統》
11.YY0719.4-2009《眼科光學 接觸鏡護理產品 第4部分:抗微生物防腐有效性試驗及測定拋棄日期指南》
12.YY0719.5-2009《眼科光學 接觸鏡護理產品 第5部分:接觸鏡和接觸鏡護理產品物理相容性的測定》
7 附錄I:接觸鏡護理產品臨牀試驗眼部觀察指標
7.1 一、結膜觀察
(一)睫狀充血
可按下列分級
0級 正常 無充血
可按下列分級
0級 正常 無充血
1級 輕度 輕度瀰漫性充血
2級 中度 明顯的侷限性或瀰漫性充血
3級 重度 瀰漫性的鞏膜淺層充血
(三)球結膜鏡片壓跡/凹陷:0爲無,1爲有。
(四)瞼結膜觀察
0級 正常 結膜面均勻光澤
1級 輕度 直徑小於1mm的輕微或散在的乳頭或濾泡
2級 中度 a)直徑小於1mm的明顯乳頭或濾泡 b)1個乳頭頂端染色
3級 重度 a)直徑1mm或以上侷限性或瀰漫性的乳頭或濾泡 b)1個以上乳頭頂端染色
上眼瞼:
2 = 中瞼結膜
3 = 下(框緣區域)瞼結膜
下眼瞼:
6 = 下眼瞼的瞼結
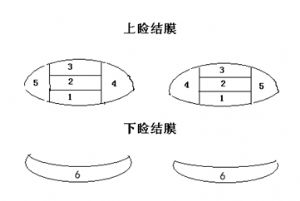
瞼結膜分區
7.2 二、角膜觀察
7.2.1 (一)角膜水腫
1.上皮水腫
0級 正常 無水腫,角膜清晰透明
1級 輕度 上皮輕度霧狀混濁
2級 中度 明顯的局部或整體上皮霧狀混濁
3級 重度 廣泛的上皮雲霧狀混濁,可能出現大泡大泡的存在與否必須說明,同時說明它們的數量。出現大泡必須看作可報告的4級嚴重上皮水腫。
0級 正常 無水腫
1級 輕度 輕度角膜中心混濁,瞳孔邊緣清晰可
2級 中度 角膜混濁,瞳孔邊界模糊可見或有後彈力層皺摺
3級 重度 角膜中心混濁,瞳孔邊界不可見出現明顯後彈力層皺褶
7.2.2 (二)角膜上皮微囊
0級 無 裂隙燈後部反光照射下未發現微囊泡
1級 輕度 中心或旁中心區角膜少量微囊,少於30個,表面無染色和其他異常
2級 中度 多量微囊出現,多於30個,並有融合,可伴有明顯染色或乾燥斑
3級 重度 大量微囊出現,大於50個,並融合成片,伴有明顯染色或上皮糜爛
7.2.3 (三)角膜內皮多形性變化(圖1)
0 級 無 年齡段正常值(40歲以下),細胞密度高(通常高於2500/mm2),大小均勻,規則六角形內皮鑲嵌,CV值(形態變異係數)<25,六角形細胞比率>65%
1 級 微度 偶有個別內皮細胞增大,CV 值 25~28六角形細胞比率<65%
2 級 輕度 個別內皮細胞增大,形態仍較規則, CV值>30 ,六角形細胞比率<60%
3級 中度 內皮細胞增大,密度有所降低,細胞大小分佈不均勻,形態不規則,CV值 >35,六角形細胞比例下降<55%
4級 重度 內皮細胞明顯增大,密度明顯降低(低於2000/mm2),大小顯著不同,形態極不規則,CV值>40,六角形細胞比例明顯下降<50%
 |  |  |  | |
| 分級 | 1級 | 2級 | 3級 | 4級 |
| CV | 27 | 33 | 38 | 49 |
| 6角形% | 60 | 56 | 51 | 46 |
7.2.4 (四)角膜新生血管形成
0 = 無 無血管延伸
1 = 微度 <1mm血管延伸
2 = 輕度 ≥1mm至≤1.5mm血管延伸
3 = 中度 >1.5 mm至≤2mm血管延伸
4 = 重度 血管延伸>2mm
另外,血管延伸的深度和位置可做下述報告:
深度: a)表層 b)基質層
位置:N鼻側 T顳側
I下方 S上方
C全周 X其他的(需具體描述)
7.2.5 (五)角膜熒光染色
角膜染色可按下列分值記錄(見其下的注1和2)
0級 正常 無染色
1級 微度 僅限於淺表上皮的點狀染色
a)散在點狀染色包括微凹染色
b)範圍≤15%
2級 輕度 局部或散在點狀染色
a)中央的或聚集的,或
b)周邊染色,包括3、9點範圍內的染色或
c)大點狀,16%—30%,可波及深層上皮,緩慢輕度基質着色,明亮
3級 中度 最大直徑超過2 mm的密集團塊狀染色
a) 角膜擦傷
b) 大點融合狀,31%—45%,深層上皮,快速侷限性基質着色,明亮
4 級 重度 直徑超過2mm的密集團塊狀染色。片狀,>45%,深層上皮,快速瀰漫性基質着色,明亮
觀察到的染色位置應以下述方式記錄,記錄位置的優選方式是使用數字標定(見圖2)。
注1:應使用觀察系統中的鈷藍光和黃色濾光鏡來觀察所有角膜染色。
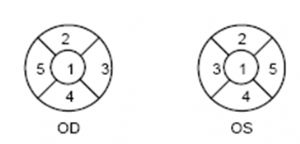
圖2記錄染色位置方法的示例
1或C 中心的
2或S 上方
3或N 鼻側
5或T 顳側
4或I 下方
7.2.6 (六)角膜浸潤
角膜點狀浸潤可按下列分級:
0級 正常 無浸潤
1級 微度 少於5個點狀浸潤
2級 輕度 大於5個少於8個點狀浸潤
3級 中度 > 8個點狀浸潤
7.2.7 (七)角膜的其他損害
8 附錄Ⅱ 視覺、屈光和接觸鏡性能以及主觀可接受程度的評價程序
8.1 一、概述
8.2 二、視覺性能
另外,在有眩光光源時,也應測試低對比的視力、對比敏感度和視覺性能。
8.3 三、屈光性能
應提供受試者戴鏡前、後的屈光度變化(球鏡度及柱鏡度)。
8.4 四、角膜散光測量
應記錄受試者角膜強弱主徑線曲率及角膜散光度和散光軸位的結果。
8.5 五、接觸鏡的配戴特性
8.5.1 (一)概述
可使用下述分類評價接觸鏡眼內配戴特性,按接觸鏡的配適狀態可分爲軟性接觸鏡和硬性接觸鏡。
8.5.2 (二)鏡片中心定位
鏡片在角膜上的穩定位置,應按如下3分值記錄:
0 = 最佳鏡片中心定位
1 = 可接受的非中心定位
2 = 不可接受的非中心定位
8.5.3 (三)鏡片移動
應記錄鏡片的移動。
眨眼後立即記錄相對於鏡片的基礎位置的鏡片移動。
下瞼上推,鏡片復位運動的結果,用下列數字記錄:
-2 = 不可接受的移動過小
-1 = 可接受的移動過小
0 = 最佳移動
+1 = 可接受的過度移動
+2 = 不可接受的過度移動
8.5.4 (四)鏡片的熒光素染色情況(硬性透氣性接觸鏡適用)
-2 = 不可以接受的陡峭配適
-1 = 可以接受的陡峭配適
0 = 平行配適
+1 = 可以接受的平坦配適
+2 = 不可以接受的平坦配適
8.6 六、鏡片表面特性
8.6.1 (一)前表面溼潤度
0 = 反射面光滑均勻
1 = 表面粗糙模糊,在每一眨眼瞬間看起來清晰,凝視時變得模糊
2 = 表面有侷限性乾燥斑(不溼潤)
3 = 鏡片表面不溼潤
8.6.2 (二)前表面沉澱物
0 = 無 表面清潔
1 = 微度 僅在淚液乾燥後可見
2 = 輕度 易去除的可見沉澱物
3 = 中度 不可去除的沉澱物
4 = 重度 不可去除的沉澱物,影響舒適度
8.6.3 (三)後表面沉澱物
0 = 無 表面清潔
1 = 微度 3點或更少的可去除微粒
2 = 輕度 最多至10點的可去除微粒
3 = 中度 3點或更少的不可去除沉積
4 = 重度 4點或更多的沉積物和(或)角膜壓跡
8.7 七、主觀可接受程度
8.7.1 (一)舒適度
0 = 疼痛, 不能接受鏡片
1 = 非常不舒服,有強烈刺激或不耐受
2 = 輕微不舒服,有刺激性或不耐受
3 = 舒適,有鏡片存在感但無刺激感
4 = 非常舒服,偶有鏡片存在感
3 = 極佳,無鏡片存在感
8.7.2 (二)視覺
0 = 不可接受,鏡片不能配戴
1 = 很差,視力不良,不可接受
2 = 差,視力模糊,但可接受
3 = 好,偶爾視力模糊,但可接受
4 = 很好,輕微視物模糊,可接
5 = 極佳,無視覺模糊
8.7.3 (三)可操作性
0 = 極差, 不能對鏡片操作
1 = 很差,有困難和非常偶爾才能成功戴上和取出
2 = 差,有困難,偶然地戴上和取出成功
3 = 好,有一些問題,但通常能成功地戴上和取出
4 = 很好, 偶爾有鏡片戴上和取出困難
5 = 極佳,鏡片的戴上和取出沒問題
8.7.4 (四)對鏡片的清潔性
0 = 極差,不能清潔鏡片
1 = 很差,基本不能清洗乾淨鏡片
2 = 差,有困難,偶然清潔困難
3 = 好,有一些問題,但通常能清理乾淨鏡片
4 = 很好, 偶爾有清潔困難
5 = 極佳,鏡片處理很乾淨