2 註解
電極電勢又稱電極電位或電極勢。它主要是由電極和電解質溶液跟電極接觸處存在雙電層而產生的平衡電勢。它跟電極電勢和電極種類、溶液中相應離子的濃度,以及溫度、壓強等因素有關。它的大小決定電極上可能發生的反應。電極電勢代數值小的電極上起氧化反應,是原電池的負極;代數值大的電極上起還原反應,是正極。
每個原電池都由兩個電極構成。原電池能夠產生電流的事實,說明在原電池的兩極之間有電勢差存在,也說明了每一個電極都有一個電勢。原電池的電動勢E就等於這兩個電極的電勢差。
由於無法直接測定各單個電極的絕對電勢的值,常用人爲規定的標準來測定電極電勢的相對值。1953年,國際純粹與應用化學聯合會(IUPAC)規定,在任意溫度下標準氫電極的電極電勢(H2)=O,並以這種電極作爲發生氧化作用的負極,以待定電極作爲發生還原作用的正極,組成電池(Pt)H2(P)|H(α=1)‖待定電極。以該電池電動勢的值和符號,作爲待定電極的電極電勢的值和符號。實際使用時,規定以25℃、1O1kPa下溶液中有關離子的有效濃度爲1mol/L(或活度爲1),且電極上參與電極反應的純物質爲最穩定的聚集態時,和標準氫電極之間的電勢差就是該電極的標準電極電勢。把各電極的標準電極電勢排成一張表以便查閱。電極電勢跟濃度的關係可以用能斯特方程式定量表示。
所謂標準電極電勢是指電極反應中有關的離子濃度爲1mol·dm-3,氣體分壓爲100kPa時電極的電勢,用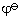 表示。故標準氫電極爲
表示。故標準氫電極爲
Pt|H2(100kPa)|H (1mol·dm-3),
 (H /H2)=0.0000V。
(H /H2)=0.0000V。
Zn2+2e-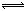 Zn(作正極)
Zn(作正極) (Zn2/Zn)=-0.7628V
(Zn2/Zn)=-0.7628V
Zn-Ze-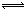 Zn2(作負極)
Zn2(作負極)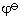 (Zn2/Zn)=-0.7628V
(Zn2/Zn)=-0.7628V
在溫度爲298.15K,濃度對電極電勢的影響根據熱力學的推導可用能斯特方程式表示。對應於任意給定的電極反應的半反應式。
a(氧化態)+ne-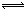 b(還原態)
b(還原態)

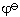 的
的