3 基本信息
ICS 11.020
C 50
中華人民共和國衛生行業標準WS/T 641—2018《臨牀檢驗定量測定室內質量控制》(Internal quality control for quantitative measurement in clinical laboratory)由中華人民共和國國家衛生健康委員會於2018年12月11日發佈,自2019年06月01日起實施。
4 前言
本標準按照 GB/T1.1—2009 給出的規則起草。
本標準在 GB/T 20468-2006《臨牀實驗室定量測定室內質量控制指南》基礎上修訂。
本標準與 GB/T 20468-2006 相比,主要修改如下:
—— 修改了術語和定義部分;
—— 增加了開展室內質量控制前的準備工作;
—— 修改了室內質量控制的實際操作;
—— 增加了室內質量控制數據的管理;
—— 刪除了分析區間;
—— 增加了資料性附錄A、附錄B和附錄C。
本標準起草單位:北京醫院、浙江省臨牀檢驗中心、首都醫科大學附屬北京朝陽醫院、中南大學湘雅醫學院湘雅醫院、上海市臨牀檢驗中心、北京和睦家醫院、華中科技大學同濟醫學院附屬同濟醫院。
本標準主要起草人:王治國、張傳寶、趙海建、王薇、康鳳鳳、張建平、胡麗濤、楊雪、孫芾、鍾堃、何法霖、費陽、章曉燕、張詩詩。
5 標準正文
5.1 1 範圍
本標準規定了對臨牀檢驗定量測定項目室內質量控制的目的、室內質量控制方法的設計、室內質量控制的實際操作、室內質量控制數據的管理、基於患者數據質量控制方法以及室內質量控制數據實驗室間比對。
本標準適用於開展臨牀檢驗服務的醫療衛生機構的臨牀實驗室的定量測定。
5.2 2 術語與定義
下列術語和定義適用於本文件。
2.1
質量控制 quality control
質量管理的一部分,致力於滿足質量要求。
[GB/T 19000-2016,3.2.10]
2.2
室內質量控制 internal quality control
檢驗人員按照一定的頻度連續測定穩定樣品中的特定組分,並採用一系列方法進行分析,按照統計學規律推斷和評價本批次測量結果的可靠程度,以此判斷檢驗報告是否可發出,及時發現並排除質量環節中的不滿意因素。
2.3
質量控制策略 quality control strategy
質控品種類、每種檢測頻次、放置的位置,以及用於質控數據解釋和確定分析批是在控還是失控的規則。
2.4
測量偏倚 measurement bias [JJF 1001 5.5]
簡稱偏倚 (bias)
系統測量誤差的估計。
2.5
測量精密度 measurement precision [JJF 1001 5.10]
簡稱精密度 (precision)
在規定條件下,對同一或類似被測對象重複測量所得示值或測量得值間的一致程度。
2.6
隨機測量誤差 random measurement error [JJF 1001 5.6]
簡稱隨機誤差 (random error)
2.7
系統測量誤差 systematic measurement error [JJF 1001 5.4]
簡稱系統誤差 (systematic error)
在重複測量中保持恆定不變或按可預見方式變化的測量誤差的分量。
2.8
實驗標準差 experimental standard deviation[JJF 1001 5.17]
對同一被測量進行n次測量,表徵測量結果分散性的量。用符號s表示。
5.3 3 開展室內質量控制前的準備工作
5.3.1 3.1 培訓實驗室檢測人員
在開展質量控制前,每個實驗室檢測人員都應對質量控制的重要性、基礎知識、質量控制的方法有較充分的瞭解,並在質量控制的實際工作中不斷進行培訓提高。
5.3.2 3.2 建立標準操作規程
實施質量控制需要有一套完整的標準操作規程(Standard Operation Procedure, SOP)。例如儀器的使用、維護操作規程,試劑、質控品、校準品等的使用操作規程等。所有臨牀實驗室都應建立一套較完整的SOP。
5.3.3 3.3 校準
對測定臨牀樣品的儀器要按一定要求進行校準,校準時要選擇合適的(配套的)校準品;如有可能,保證檢測結果能溯源到參考方法或/和參考物質;對不同的分析項目要根據其特性確立各自的校準頻率。
5.3.4 3.4 質控品
5.3.4.1 3.4.1 特性
質控品應與患者待測樣本具有相似或相同的基質。質控品應均一和穩定,如條件允許,可儲存一年或以上的用量。瓶間變異性應小於分析系統的變異。如果沒有商品化質控品,實驗室可以自制質控品。
5.3.4.2 3.4.2 質控品中分析物的濃度
所選質控品的濃度應位於臨牀有意義的濃度範圍內。
若使用定值質控品,使用說明書上的原有標定值只能作參考。必須由實驗室作重複測定來確定暫定和常用均值以及標準差。
5.4 4 室內質量控制方法的設計
5.4.1 4.1 質量控制方法選擇和設計表格
質控選擇表格是一種3×3表格,其確定了適合於九種不同分類檢驗程序的質控方法(質控規則和每批質控測定結果個數N)。對單規則固定限質控方法建立質控選擇和設計表格,如Levey -Jennings質控圖;以及對多規則質控方法建立質控選擇和設計表格,如多規則質控方法。表1和表2分別顯示出兩種質控選擇和設計表格。表格的行由醫學上重要的系統誤差大小(△SEc)描述過程能力(processcapability)。表格的列由誤差發生率(frequency of errors, f) 描述過程的穩定性。
臨界系統誤差△SEc = [(TEa - |bias| )/CV] - 1.65)
允許總誤差(TEa)目前可採用全國臨牀檢驗室間質量評價標準和國家衛生健康委員會行業標準等。
按照檢驗程序評價方案對本實驗室定量測定的性能參數逐一進行評價,確定每一項目的不精密度(用CV%表示)和偏倚(用bias%表示)。
表1 單規則固定限質控方法設計表格
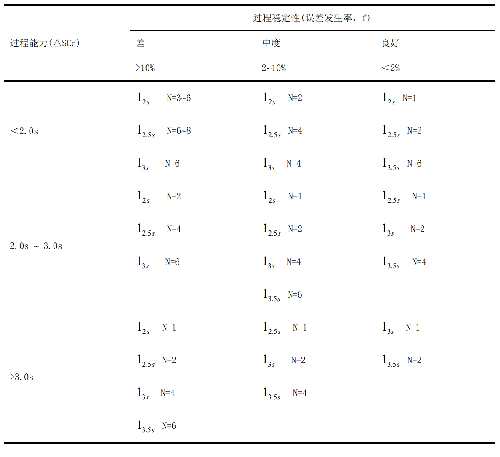
表2 多規則方法質控設計表格

在表格內,N是每批質控測定結果個數。 多規則質控方法由“/”把質控規則聯合起來,例如,13s /(41sW)是兩個單規則的聯合,具有W的規則表明用它作“警告”規則,而不是判斷失控的規則。
5.4.2 4.2 西格瑪圖法
5.4.2.1 4.2.1 西格瑪規則圖法
將經典的Westgard多規則邏輯判斷圖和6σ結合建立西格瑪規則圖,見圖1和圖2。計算西格瑪度量值可描述測量程序的精密度和正確度與質量要求之間的關係,同時可計算醫學重要的臨界系統誤差,然後根據臨界系統誤差和質量控制方法的性能,選擇適當的質控規則和每批質控測定值個數。σ度量值可以由下列公式計算:σ=[(TEa - |bias|)/ CV],其中TEa爲允許總誤差,bias和CV表示檢驗程序觀測的偏倚和不精密度(變異係數)。
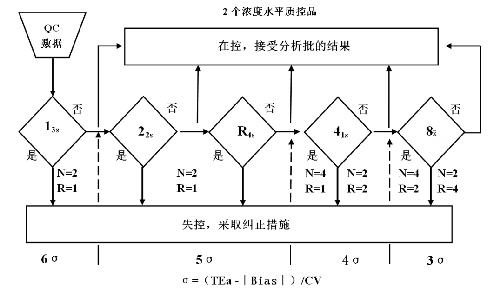
圖1 2 個濃度水平質控品的西格瑪規則
(N代表每批質控測定結果個數,R代表批數)

圖2 3 個濃度水平質控品的西格瑪規則
(N代表每批質控測定結果個數,R代表批數)
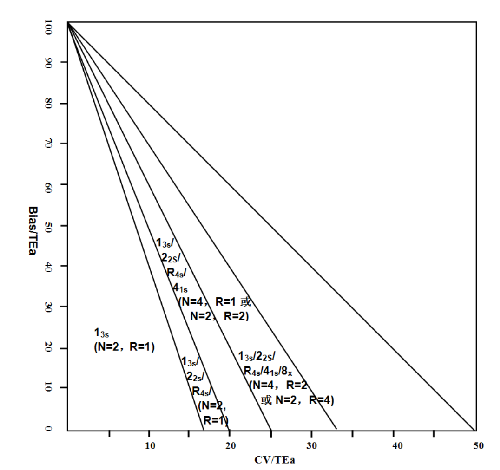
5.4.2.2 4.2.2 標準化西格瑪性能驗證圖法
用允許總誤差、偏倚和變異係數繪製標準化西格瑪性能驗證圖(見圖 3)。圖中斜線劃分的區域從
右上到左下依次代表“σ<2(不可接受)”,無可選的質控規則;“2≤σ<3(欠佳)”,無可選的質控規
則;“3≤σ<4(臨界)”,13s/22s/R4s/41s/8x多規則,N=4,R=2 或 N=2,R=4;“4≤σ<5(良好)”,13s/22s/R4s/41s
多規則,N=4,R=1 或 N=2,R=2;“5≤σ<6(優秀)”,13s/22s/R4s多規則,N=4,R=1或 N=2,R=2;和“σ≥6(世界一流)”,13s規則,N=2,R=1。
將實驗室某個定量測定項目獲得的 CV 和 bias 分別除以該項目的允許總誤差(TEa), 得到 x 軸和y 軸數值,根據上述的值可以確定該項目在圖上的位置,根據其位置就可以找到相應的質控規則。
5.5 5 室內質量控制的實際操作
5.5.1 5.1 設定中心線(均值)
5.5.1.1 5.1.1 穩定性較長的質控品
在開始室內質量控制時,首先要設定質控品的均值。各實驗室應對新批號的質控品的各個測定項目自行確定均值。均值必須在實驗室內使用自己現行的檢驗程序進行確定。定值質控品的標定值只能作爲確定均值的參考。
5.5.1.1.1 5.1.1.1 暫定均值的設定
爲了確定暫定均值,新批號的質控品應與當前使用的質控品一起進行測定。根據20或更多獨立批獲得的至少20次質控測定結果(剔除異常值或離羣值),計算出平均數,作爲暫定均值。
以此暫定均值作爲下一個月室內質控圖的中心線進行室內質控;一個月結束後,將該月的在控結果與前20個質控測定結果彙集在一起,計算累積平均數(第一個月),以此累積的平均數作爲下一個月質控圖的均值。
重複上述操作過程,連續三至五個月,或逐月不斷進行累積。
5.5.1.1.2 5.1.1.2 常用均值的設立
以最初20個數據和三至五個月在控數據彙集的所有數據計算的累積平均數作爲質控品有效期內的常用均值,並以此作爲以後室內質控圖的平均數。對個別在有效期內濃度水平不斷變化的項目,則需不斷調整均值。
5.5.1.2 5.1.2 穩定性較短的質控品
在3~4天內,每天分析每水平質控品3~4瓶,每瓶進行2~3次重複。收集數據後,計算平均數、標準差和變異係數。對數據進行異常值檢驗。如果發現異常值,需重新計算餘下數據的平均數和標準差。以此均值作爲質控圖的中心線。
5.5.2 5.2 設定控制限
5.5.2.1 5.2.1 穩定性較長的質控品
5.5.2.1.1 5.2.1.1 暫定標準差的設定
爲了確定標準差,新批號的質控品應與當前使用的質控品一起進行檢測。根據20或更多獨立批獲得的至少20次質控測定結果(剔除異常值或離羣值),計算出標準差,並作爲暫定標準差。
以此暫定標準差作爲下一個月室內質控圖的標準差進行室內質控;一個月結束後,將該月的在控結果與前20次質控測定結果彙集在一起,計算累積標準差(第一個月),以此累積的標準差作爲下一個月質控圖的標準差。
重複上述操作過程,連續三至五個月,或逐月不斷進行累積。
5.5.2.1.2 5.2.1.2 常用標準差的設定
以最初20次質控檢測結果和三至五個月在控質控結果彙集的所有數據計算的累積標準差作爲質控品有效期內的常用標準差,並以此作爲以後室內質控圖的標準差。
5.5.2.2 5.2.2 穩定性較短的質控品
至於標準差,使用的數據量越大,其標準差估計值將更好。由於這個原因,我們並未推薦使用5.2.1中的重複數據來建立新的標準差。而是採用以前變異係數(CV)來估計新的標準差。
以前的標準差是幾個月數據的簡單平均或甚至是累積的標準差。這就考慮了檢測過程中更多的變異。標準差等於上述平均數乘以以前變異係數(CV)。
也可以採用加權平均的不精密度(CV%)乘以上述重複試驗得出的均值得出標準差,作爲暫定的標準差。
加權平均的不精密度(CV%)是基於累積的長期CV%,累積的不精密度包含了不同時間同一儀器相同質控品不同批次之間的預期變異。對每一批號質量控制批的數量不同,可以按照以下示例進行計算,見表3。
表3 白細胞計數的質控情況
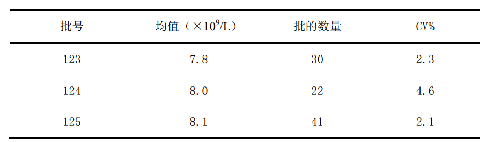
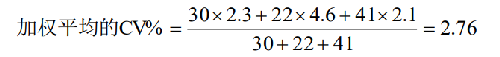
這個加權平均的 CV%值不是 3 個 CV 值簡單的平均值(爲 3.0%)。在收集這些數據時不能拋除之前質控批次的數據。除非有合理的原因,否則會使累積的 CV%值錯誤地偏低。用新批次的均值和加權平均的CV%計算該批號合適的標準差(s)。假定新批號的 WBC 的均值爲 7.5,使用上面所得的加權平均的 CV%值 2.76,得出:
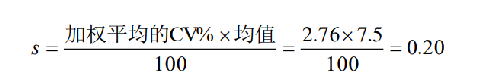
待此一個月結束後,將該月在控結果與前面建立質控圖的質控結果彙集在一起,計算累積平均值和標準差,以此累積的平均值和標準差作爲再下一個月質控圖的中心線和標準差;重複上述操作過程,並進行逐月累積。
5.5.2.3 5.2.3 控制限的設定
控制限通常是以標準差的倍數表示。臨牀實驗室不同項目(定量測定)的控制限的設定要根據其採用的質控規則來決定。
5.5.3 5.3 質控品的檢測
5.5.3.1 5.3.1 應用
5.5.3.2 5.3.2 質控品檢測的頻次
在每一個分析批內至少對質控品作一次檢測。檢測系統或試劑的廠商應推薦每個分析批使用質控品數量。用戶根據不同情況,可增加或減少質控品測定次數。
5.5.3.3 5.3.3 質控品的位置
用戶應確定每批內質控品的位置,原則是在報告一批患者檢測結果前,應對質控結果作出評價。確定質控品的位置須考慮分析方法的類型及可能產生的誤差類型。例如,在用戶規定批長度內,進行非連續樣品檢測,質控品放在標本檢驗結束前,可監測偏倚;如將質控品平均分佈於整個批內,可監測漂移;若隨機插於患者樣品中,可檢出隨機誤差。在任何情況下,都應在報告患者檢測結果前評價質量控制結果。
5.5.3.4 5.3.4 更換質控品
擬更換新批號的質控品時,應在“舊”批號質控品使用結束前,新批號的質控品應與“舊”批號質控品一起測定,重複5.1和5.2的過程,設立新的均值和控制限。
5.5.4 5.4 繪製質控圖及記錄質控結果
質控圖是對過程質量加以測定和記錄,從而評估和監察過程是否處於控制狀態的一種統計方法設計的圖。圖上有中心線(central line,CL)、上控制限(upper control limit,UCL)和下控制限(lower control limit,LCL),並有按時間順序排列的質控結果或質控結果統計量值的描點序列。根據質控品的均值和控制限繪製Levey-Jennings質控圖(單一濃度水平),或將不同濃度水平繪製在同一圖上的Z分數圖,或Youden圖。將原始質控結果記錄在質控圖表上。保留打印或電子的原始質控記錄。
5.5.5 5.5 質控規則的應用
將設計的質控規則應用於質控測定結果,判斷每一分析批是在控還是失控。
5.5.6 5.6 失控情況處理及原因分析
5.5.6.1 5.6.1 失控情況處理
操作者在測定質控品時,如發現質控數據違背了控制規則,應填寫失控報告單,上交專業室主管(組長),由專業室主管(組長)做出是否發出與測定質控品相關的那批患者樣品檢驗報告的決定。
5.5.6.2 5.6.2 失控原因分析
提示失控時受多種因素的影響,這些因素包括操作上的失誤,試劑、校準物、質控品的失效,儀器維護不良以及採用的質控規則、控制限範圍,一次測定的質控品數等。提示失控時就意味着與測定質控品相關的那批患者樣品報告可能作廢。此時,首先要儘量查明導致失控的原因,然後再隨機挑選出一定比例的患者樣品進行重新測定,最後根據預先設定標準判斷先前測定結果是否可接受,對失控做出恰當的判斷。對判斷爲真失控的情況,應該在重做質控結果在控以後,對相應的所有失控患者標本進行重新測定。如失控信號被判斷爲假失控時,常規測定報告可以按原先測定結果發出,不必重做。
當提示失控時,可採取的分析步驟爲:應首先確定失控類型、分析查找原因、針對原因採取糾正措施、驗證糾正措施的有效性、驗證措施有效後恢複檢驗、評估最後一次成功質量控制活動後患者樣品的檢驗結果、填寫失控報告。
5.5.6.3 5.6.3 消除失控的原因
對失控的最佳處理是確認問題的原因,發現問題並提出妥善解決的辦法,消除失控的原因,並防止以後再次發生。
5.5.6.4 5.6.4 驗證患者結果
實驗室應建立制度,在出現質控失控時,有相應措施驗證患者檢測結果。
5.6 6 室內質量控制數據的管理
5.6.1 6.1 每月或規定時間內室內質量控制數據統計處理
每個月的月末、最後一批檢測結果結束後或規定時間內,應對所有質控數據進行匯總和統計處理,計算的內容至少應包括:
(1)當月或規定時間內每個測定項目原始質控數據的平均數、標準差和變異係數。
(2)當月或規定時間內每個測定項目除外失控數據後的平均數、標準差和變異係數。
(3)當月或規定時間內及以前每個測定項目除外失控數據後的所有質控數據的累積平均數、標準差和變異係數。
5.6.2 6.2 每月或規定時間內室內質量控制數據的保存
每個月的月末或規定時間內,應將所有質控數據彙總整理後存檔保存,存檔的質控數據包括:
(1)當月或規定時間內所有項目原始質控數據。
(2)當月或規定時間內所有項目質控數據的質控圖。
(3)6.1項內所有計算的數據(包括平均數、標準差、變異係數及累積的平均數、標準差、變異係數等)。
(4)當月或規定時間內的失控報告單(包括違背哪一項失控規則,失控原因,採取的糾正措施)。
5.6.3 6.3 每月或規定時間內上報的質量控制數據圖表
每個月的月末或規定時間內,將所有質控數據彙總整理後,應將以下彙總表上報實驗室負責人:
(1)當月或規定時間內所有測定項目質控數據彙總表。
(2)所有測定項目當月或規定時間內的失控情況彙總表。
5.6.4 6.4 室內質量控制數據的週期性評價
每個月的月末或規定時間內,都要對當月或規定時間內室內質控數據的平均數、標準差、變異係數及累積平均數、標準差、變異係數進行評價,查看與以往各月的平均數之間、標準差之間、變異係數之間是否有明顯不同。如果發現有顯著性的變異,就要對質控圖的均值、標準差進行修改,並要對質控方法重新進行設計。
5.7 7 應用患者數據的質量控制方法
5.7.1 7.1 患者結果均值法
5.7.1.1 7.1.1 正態均值法
執行患者結果均值法進行質量控制時應考慮如下五個重要的參數或統計量,即:①患者樣品數據的
平均值(![]() ),②患者樣品測定結果的總體標準差(sp),③分析標準差(sa),④計算患者樣品平均值的標本量(Np),⑤質控界限確定的假失控概率(Pfr)。此外還應考慮患者樣品均值捨棄異常值的界限(上限和下限)。
),②患者樣品測定結果的總體標準差(sp),③分析標準差(sa),④計算患者樣品平均值的標本量(Np),⑤質控界限確定的假失控概率(Pfr)。此外還應考慮患者樣品均值捨棄異常值的界限(上限和下限)。
5.7.1.2 7.1.2 移動均值法
移動均值法是建立在連續的20個患者紅細胞指數(MCV、MCH、MCHC)的多組均值基礎上,此種算法的原理簡單,但公式很複雜。移動均值法的控制限一般定爲±3%。移動均值的另外一種形式是最近三個移動均值的均值超過2%就算失控。
5.7.2 7.2 差值檢查法
對某一具體的患者來說,若其情況穩定,則患者前後試驗結果也應基本穩定。因此,在患者情況穩定時,患者連續試驗結果之間的差值,即△(delta)值應該很小。如果△值很大並超過預先規定的界限,則表明存在下列三種可能情況之一:(1)患者樣品的試驗結果確實有了變化;(2)標本標記錯誤或混亂;(3)計算△值的兩個結果值之一有誤差。
通常以下列兩種方式之一來計算△值:
△(實驗單位) =第二次結果-第一次結果
△(%) = 100×(第二次結果-第一次結果)/第二次結果
5.7.3 7.3 患者樣品雙份檢測的極差質控圖法
某些檢驗程序採用雙份檢測。此時使用患者樣品雙份檢測值的差異能確定檢驗程序的批內標準差。也能應用雙份檢測的極差來檢出批內隨機誤差。
雙份檢測值的差值可以繪製在休哈特極差質控圖上,其質控界限可從差值的標準差計算出來。也可由下面的公式從雙份檢測的標準差(s雙)導出雙份檢測極差的控制限:

5.8 8 對室內質量控制數據進行實驗室間比對
5.8.1 8.1 對質控品室內質量控制數據進行實驗室間比對
若多個實驗室共用同一批號的質控品,可將報告結果組織一個實驗室間比對計劃。
由該計劃的數據獲得統計資料,用來確定:
(1)實驗室內和實驗室間不精密度;
作爲實驗室自我評價,相對於方法學組的偏倚及相對不精密度是有用的參數。對室內質量控制數據進行實驗室間比對對完善室間質量評價提供了有效的補償。因此,應鼓勵實驗室積極地參與室內質控數據的實驗室間比對計劃。
5.8.2 8.2 對患者數據百分位數(中位數)進行實驗室間比對
患者數據百分位數(中位數)監測爲廠家和實驗室提供了評估實驗質量、可比性、穩定性以及變異來源的方法,也提供了質量是如何在常規條件下持續的證據,還可用於發現主要偏倚來源。該方法將患者樣品檢測結果的統計量進行比對,並與日常室內質量控制的觀察聯繫在一起,是改進患者醫療現代化的質量管理工具。
6 附錄A(資料性附錄)常用質控規則及含義
質控規則用於解釋質控測定結果和判斷分析批控制的狀態。以符號AL表示, 其中A是超過控制限(L)的質控測定結果個數或質控測定結果的統計量,L是控制限。當質控測定結果滿足規則要求的條件時,則判斷該分析批違背此規則。
12s: 表示一個質控測定結果超過![]() ±2s,如違背此規則,提示警告。
±2s,如違背此規則,提示警告。
12.5s: 表示一個質控測定結果超過![]() ±2.5s,如違背此規則,提示存在隨機誤差。
±2.5s,如違背此規則,提示存在隨機誤差。
3s1: 表示一個質控測定結果超過![]() ±3s,如違背此規則,提示存在隨機誤差。
±3s,如違背此規則,提示存在隨機誤差。
R4s: 表示同批兩個質控測定結果之差值超過4s, 即一個質控測定結果超過![]() +2s,另一質控測定結果超過
+2s,另一質控測定結果超過![]() -2s,如違背此規則,表示存在隨機誤差。
-2s,如違背此規則,表示存在隨機誤差。
22s: 表示兩個連續質控測定結果同時超過![]() +2s 或
+2s 或![]() -2s,如違背此規則,表示存在系統誤差。
-2s,如違背此規則,表示存在系統誤差。
41s: 表示一個質控品連續的四次測定結果都超過![]() +1s或
+1s或![]() -1s,兩個質控品連續兩次測定結果都超過
-1s,兩個質控品連續兩次測定結果都超過![]() +1s或
+1s或![]() -1s,如違背此規則,表示存在系統誤差。
-1s,如違背此規則,表示存在系統誤差。
![]() : 表示八個連續的質控測定結果在平均數一測,如違背此規則,表示存在系統誤差。
: 表示八個連續的質控測定結果在平均數一測,如違背此規則,表示存在系統誤差。
7 附錄B(資料性附錄)功效函數圖法
7.1 B.1 確定允許總誤差
目前可採用衛生部臨牀檢驗中心使用的全國臨牀檢驗室間質量評價標準、國家衛生健康委員會行業標準或根據生物學變異導出的允許總誤差(TEa)。
7.2 B.2 評價檢驗程序
按照檢驗程序評價方案對本實驗室定量測定的性能參數逐一進行評價,確定每一項目的不精密度(用CV%表示)和偏倚(用bias%表示)。
7.3 B.3 計算臨界系統誤差
臨界系統誤差△SEc = [(TEa - |bias| )/CV] - 1.65)
7.4 B.4 繪製功效函數圖
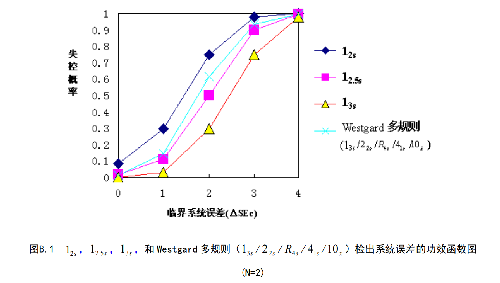
功效函數圖描述了質控方法的統計“功效”,其中y軸爲誤差檢出概率Ped,x軸爲臨界誤差大小。圖B.1爲不同質控規則臨界系統誤差的功效函數圖。
圖B.1
7.5 B.5 評價質控方法的性能特徵
7.6 B.6 選擇質控規則及質控測定值個數
根據評價的結果,選擇的質控方法既要有高的誤差檢出概率和低的假失控概率,又要簡單、方便計算。通常誤差檢出概率達90%以上,而假失控概率在5%以下就可滿足一般臨牀實驗室的要求。
8 附錄C(資料性附錄)操作過程規範圖法
操作過程規範(operational process specifications,OPSpecs)圖顯示的是檢驗程序的不精密度、偏倚和需要採用的質控方法之間的一種線條圖。它表述了爲達到允許的不精密度和偏倚所應採用的統計質控方法,以及保證常規操作能達到預期質量要求的概率。OPSpecs圖可用於證實當前統計質控方法是否適當,或選擇新的質控方法是否能達到分析質量要求。由於不需計算臨界誤差,並減少了不必要的操作,應用OPSpecs圖可簡化設計質控方法的過程。
圖C.1爲OPSpecs示意圖,此圖能保證90%測定結果不超過10%的允許總誤差。此OPSpecs圖中y軸爲允許的偏倚(bias%),x軸爲允許的不精密度(CV%)。圖中最上面的斜線(實線)表示不精密度和偏倚的最大允許限,規定總誤差爲偏倚(bias)+ 2s,此總誤差也常用於方法評價時判斷該方法性能是否可接受的標準。下面的各條斜線(虛線)分別表示當測定方法不穩定、存在系統誤差時,需要用不同的質控方法(每條斜線代表一種質控方法)進行質控時的常規操作限。使用OPSpecs圖時,將測定方法的不精密度和偏倚畫在圖上,確定實驗室的操作點,然後將它與不同質控方法的常規操作限比較。常規操作限高於操作點的質控方法是可採用的,它們可達到所規定的質量保證水平,成爲候選的質控方法。但質控方法的最終選擇還要考慮所需質控測定結果個數、失控概率及執行的難易程度。
根據各臨牀實驗室的長期室內質控測定結果可估計出檢驗程序的固有不精密度或隨機誤差(CV%),根據檢驗程序的確認或驗證,或正確度驗證室間質量評價計劃得到偏倚 (bias%)。
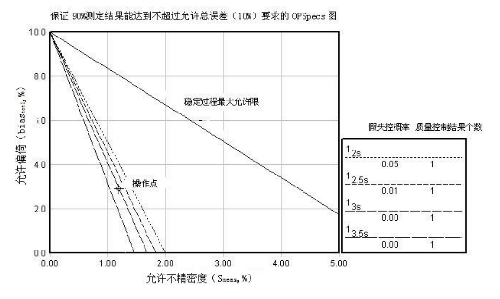
圖C.1 操作過程規範圖
9 參考文獻
[1] Westgard JO, Barry PL,Hunt MR. A multirule Shewart chart for quality control in clinical chemistry. Clin Chem. 1981;27:493-501.
[2] Westgard JO, Barry PL.Cost-Effective Quality Control: Managing the Quality and Productivity of Analytical Processes. Washington, DC: AACC Press; 1986:230.
[3] Hyltoft Petersen P, Ricos C, Stöckl D, et al. Proposed guidelines for the internal quality control of analytical results in the medical laboratory. Eur J Clin Chem Biochem. 1996;34:983-999.
[4] Westgard JO. Internal quality control: planning and implementation strategies. Ann Clin Biochem. 2003;40(Pt 6):593-611.
[5] Westgard JO. Six Sigma Quality Design & Control: Desirable Precision and Requisite QC for Laboratory Measurement Processes. 2nd ed. Madison, WI: Westgard QC, Inc.; 2006.
[6] CLSI C24A3. Statistical quality control for quantitative measurement procedures: principles and definitions. 3rd Ed. Wayne (PA): Clinical and Laboratory Standards Institute; 2006.
[7] CLSI C24-Ed4. Statistical quality control for quantitative measurement procedures: principles and definitions. 4th Ed. Wayne (PA): Clinical and Laboratory Standards Institute; 2016.
[8] Westgard JO. Basic QC Practices, 4th ed. Madison, WI: Westgard QC, Inc., 2016.
[9] 楊振華主編.臨牀實驗室管理(供醫學檢驗專業用).北京:人民衛生出版社, 2003.
[10] 申子瑜主編. 醫院管理學-臨牀實驗室管理分冊. 北京:人民衛生出版社,2003.
[11] 李萍主編.臨牀實驗室管理學(全國高等學校醫學規劃教材).北京:高等教育出版社,2006.
[12] 申子瑜, 李萍主編. 《臨牀實驗室管理學》(第二版).北京:人民衛生出版社,2007.
[13] 陳文祥主編.醫院管理學-臨牀實驗室管理分冊(第2版).北京:人民衛生出版社, 2011.
[14] 王治國主編.臨牀檢驗質量控制技術(第3版).北京:人民衛生出版社, 2014.
[15] 王治國主編.臨牀檢驗6質量設計與控制.北京:人民衛生出版社,2012.
[16] 王治國等主編.臨牀檢驗質量指標. 北京:人民衛生出版社,2016.
[17] 王治國主編.臨牀檢驗生物學變異與參考區間. 北京:人民衛生出版社,2012.
[18] 中國國家標準化管理委員會.中華人民共和國國家標準GB/T 20468-2006 臨牀實驗室定量測定室內質量控制指南.北京:中國標準出版社,2006.
[19] 李婷婷,王薇,趙海建,等.解讀新ISO指南80:質控品實驗室內部製備指南.中華檢驗醫學雜誌,2016,39(12):988-990.