2 附錄Ⅹ A 重組乙型肝炎疫苗(酵母)體外相對效力檢查法
本法系以酶聯免疫法測定供試品中的乙型肝炎病毒表面抗原(HBsAg)含量,並以參考品爲標準,採用雙平行線分析法計算供試品的相對效力。
2.1 試劑
(1) PBS (pH7.2) 稱取氯化鈉8.850g、磷酸二氫鈉(NaH2PO4·2H2O) 0.226g和磷酸氫二鈉(Na2HPO4·12H2O)1.698g,加適量水溶解,調pH值至7.2,加水稀釋至1000ml。
(2)供試品處理液 量取20%二乙醇胺1.25ml和10% Triton X-100 0.20ml,加PBS 8.55ml,混勻備用。
(3)供試品稀釋液 稱取牛血清白蛋白10.0g,加PBS溶解並稀釋至1000ml,備用。
2.2 參考品溶液及供試品溶液的製備
精密量取參考品及供試品各0.1ml,分別加入0.1ml供試品處理液,加盞混勻,在20~28℃靜置30~35分鐘。將處理後的參考品和供試品分別以供試品稀釋液進行適當稀釋,稀釋後取1: 2000、1: 4000、1: 8000、1: 16000、1:32000及其他適宜稀釋度進行測定,每個稀釋度做雙份測定。陰性對照爲供試品稀釋液(雙份),陰性對照和陽性對照均不需稀釋。
2.3 測定法
按試劑盒使用說明書進行。試劑盒陰性和陽性對照的吸光度均值應在試劑盒要求範圍內,試驗有效。3次測定的數據均用量反應平行線測定法(2010年版藥典二部附錄XIV)計算相對效力。以3次相對效力的幾何均值爲其體外相對效力。以參考品爲標準,供試品相對效力應不小於0.5,判爲合格。
3 附錄Ⅹ B 重組人促紅素體內生物學活性測定法(網織紅細胞法)
本法系依據人促紅素(EPO)可刺激網織紅細胞生成的作用,給小鼠皮下注射EPO後,其網織紅細胞數量隨EPO注射劑量的增加而升高。利用網織紅細胞數對紅細胞數的比值變化,通過劑量反應平行線法檢測EPO體內生物學活性。
3.1 試劑
(1)乙二胺四乙酸二鉀抗凝劑 稱取乙二胺四乙酸二鉀100mg,加生理氯化鈉溶液10ml溶解,混勻,使用時新鮮配製。
(2)稀釋液 稱取0.1g牛血清白蛋白,加生理氯化鈉溶液溶解並稀釋至100ml,即得。
3.2 標準品溶液的製備
按標準品介紹,將EPO標準品復溶,用稀釋液將EPO標準品稀釋成高、中、低3個劑量EPO標準品溶液。
3.3 供試品溶液的製備
用稀釋液將供試品稀釋成高、中、低3個劑量與EPO標準品溶液單位相近的供試品溶液。
3.4 測定法
按低、中、高(如10IU/鼠、20IU/鼠、40IU/鼠)3個劑量組,分別給近交系6~8周齡小鼠(雌性BALB/C小鼠)或B6D2F1小鼠皮下注射EPO標準品及供試品溶液,每組至少4只,每鼠注射量爲不大於0.5ml。在注射後的第4天從小鼠眼眶採血3~4滴,置於預先加入200μl EDTA-K2抗凝劑的採血管中。取抗凝血,用全自動網織紅細胞分析儀計數每隻小鼠血液中的網織紅細胞數對紅細胞總數的比值(Ret%)。按注射劑量(IU)對Ret%的量反應平行線測定法(2010年版藥典二部附錄XIV)計算供試品體內生物學活性。
4 附錄Ⅹ C 干擾素生物學活性測定法(細胞病變抑制法)
本法系依據干擾素可以保護人羊膜細胞(WISH)免受水泡性口炎病毒(VSV)破壞的作用,用結晶紫對存活的WISH細胞染色,在波長570nm處測定其吸光度,可得到干擾素對WISH細胞的保護效應曲線,以此測定干擾素生物學活性。
4.1 試劑
(1) MEM或RPMI 1640培養液 取MEM或RPMI 1640培養基粉末1袋(規格爲1L),加水溶解並稀釋至1000ml,加青黴素105IU和鏈黴素105IU,再加碳酸氫鈉2.1g,溶解後,混勻,除菌過濾,4℃保存。
(2)完全培養液 量取新生牛血清10ml,加MEM或RPMI 1640培養液90ml。4℃保存。
(3)測定培養液 量取新生牛血清7ml,加MEM或RPMI 1640培養液93ml。4℃保存。
(4)攻毒培養液 量取新生牛血清3ml,加MEM或RPMI 1640培養液97ml。4℃保存。
(5)消化液 稱取乙二胺四乙酸二鈉0.2g、氯化鈉8.0g、氯化鉀0.2g、磷酸氫二鈉1.152g、磷酸二氫鉀0.2g,加水溶解並稀釋至1000ml,經121℃、15分鐘滅菌。
(6)染色液 稱取結晶紫50mg,加無水乙醇20ml溶解後,加水稀釋至100ml,即得。
(7)脫色液 量取無水乙醇50ml、醋酸0.1ml,加水稀釋至100ml。
(8) PBS 稱取氯化鈉8.0g、氯化鉀0.20g、磷酸氫二鈉1.44g、磷酸二氫鉀0.24g,加水溶解並稀釋至1000ml,經121℃、15分鐘滅菌。
4.2 標準品溶液的製備
取人干擾素生物學活性測定的國家標準品,按介紹復溶後,用測定培養液稀釋至每1ml含1000IU。在96孔細胞培養板中,做4倍系列稀釋,共8個稀釋度,每個稀釋度做2孔。在無菌條件下操作。供試品溶液的製備 將供試品按標示量溶解後,用測定培養液稀釋成每1ml約含1000IU。在96孔細胞培養板中,做4倍系列稀釋,共8個稀釋度,每個稀釋度做2孔。在無菌條件下操作。
4.3 測定法
使WISH細胞在培養基中貼壁生長。按(1:2)~(1:4)傳代,每週2~3次,於完全培養液中生長。取培養的細胞棄去培養液,用PBS洗2次後消化和收集細胞,用完全培養液配製成每1ml含2.5×105~3.5×105個細胞的細胞懸液,接種於96孔細胞培養板中,每孔100μl,於37℃、5%二氧化碳條件下培養4~6小時;將配製完成的標準品溶液和供試品溶液移入接種WISH細胞的培養板中,每孔加入100μl,於37℃、5%二氧化碳條件下培養18~24小時;棄去細胞培養板中的上清液,將保存的水泡性口炎病毒(VSV,-70℃保存)用攻毒培養液稀釋至約100CCID50,每孔100μl,於37℃、5%二氧化碳條件下培養24小時(鏡檢標準品溶液的50%病變點在1IU/ml);然後棄去細胞培養板中的上清液,每孔加入染色液50μl,室溫放置30分鐘後,用流水小心衝去染色液,並吸乾殘留水分,每孔加入脫色液100μl,室溫放置3~5分鐘。混勻後,用酶標儀以630nm爲參比波長,在波長570nm處測定吸光度,記錄測定結果。
試驗數據採用計算機程序或四參數迴歸計算法進行處理,並按下式計算結果:
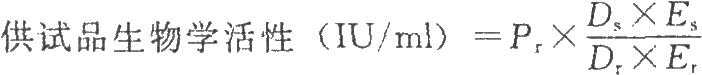
DS爲供試品預稀釋倍數;
Dr爲標準品預稀釋倍數;
ES爲供試品相當於標準品半效量的稀釋倍數;
Er爲標準品半效量的稀釋倍數。
5 附錄Ⅹ D 重組人白介素-2生物學活性測定法(CTLL-2細胞/MTT比色法)
本法系依據在不同白介素-2 (IL-2)的濃度下,其細胞依賴株CTLL-2細胞存活率不同,以此檢測IL-2的生物學活性。
5.1 試劑
(1) RPMI 1640培養液 取RPMI 1640培養基粉末1袋(規格爲1L),加水溶解弗稀釋至1000ml,加青黴素105IU和鏈黴素105IU,再加碳酸氫鈉2.1g,溶解後,混勻,除菌過濾,4℃保存。
(2)基礎培養液 量取新生牛血清(FBS) 10ml,加RPMI 1640培養液90ml。4℃保存。
(3)完全培養液 量取基礎培養液100ml,加重組人白介素-2至終濃度爲每1ml含400~800IU。4℃保存。
(4) PBS 稱取氯化鈉8.0g、氯化鉀0.20g、磷酸氫二鈉1.44g、磷酸二氫鉀0.24g,加水溶解並稀釋至1000ml,經121℃、15分鐘滅菌。
(5)噻唑藍(MTT)溶液 稱取MTT 0.1g,加PBS溶解並稀釋至20ml,經0.22μm濾膜過濾除菌。4℃避光保存。
(6)裂解液 15%十二烷基硫酸鈉溶液,使用期限不得超過12個月。
5.2 CTLL-2細胞
應爲偏酸性、略微渾濁液體,傳代後48~60小時用於重組人白介素-2生物學活性測定。
5.3 標準品溶液的製備
取重組人白介素-2生物學活性測定的國家標準品,按使用說明書復溶後,用基礎培養液稀釋至每1ml含200IU。在96孔細胞培養板中,做2倍系列稀釋,共8個稀釋度,每個稀釋度做2孔。每孔分別留50μl標準品溶液,棄去孔中多餘溶液。以上操作在無菌條件下進行。
5.4 供試品溶液的製備
將供試品按標示量復溶後,用基礎培養液稀釋成每1ml約含200IU。在96孔細胞培養板中,做2倍系列稀釋,共8個稀釋度,每個稀釋度做2孔。每孔分別留50μl供試品溶液,棄去孔中多餘溶液。以上操作在無菌條件下進行。
5.5 測定法
CTLL-2細胞用完全培養液於37℃、5%二氧化碳條件下培養至足夠量,離心收集CTLL-2細胞,用RPMI 1640培養液洗滌3次,然後重懸於基礎培養液中配製戚每1ml含6.0×105個細胞的細胞懸液,於37℃、5%二氧化碳條件下備用。在加有標準品溶液和供試晶溶液的96孔細胞培養板中,每孔加入細胞懸液50μl.於37℃、5%二氧化碳條件下培養18~24小時;然後每孔加入MTT溶液20μl.於37℃、5%二氧化碳條件下培養4~6小時後,每孔加入裂解液150μl,於37℃、5%二氧化碳條件下保溫18~24小時。以上操作均在無菌條件下進行。混勻細胞板中的液體,放入酶標儀,以630nm爲參比波長,在波長570nm處測定吸光度,記錄測定結果。
試驗數據採用計算機程序或四參數迴歸計算法進行處理,並按下式計算結果:
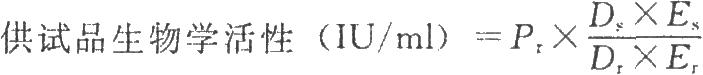
DS爲供試品預稀釋倍數;
Dr爲標準品預稀釋倍數;
ES爲供試品相當於標準品半效量的稀釋倍數;
Er爲標準品半效量的稀釋倍數。
6 附錄Ⅹ E 重組人粒細胞刺激因子生物學活性測定法(NFS-60細胞/MTT比色法)
本法系依據小鼠骨髓白血病細胞(NFS-60細胞)的生長狀況因重組人粒細胞刺激因子(G-CSF)生物學活性的不同而不同,以此檢測G-CSF的生物學活性。
6.1 試劑
(1) RPM1 1640培養液 取RPMI 1640培養基粉末1袋(規格爲1L),加水溶解並稀釋至1000ml,加膏黴素105IU和鏈黴素105IU,再加碳酸氫鈉2.1g,溶解後,混勻,除菌過濾,4℃保存。
(2)基礎培養液 量取新生牛血清100ml,加入RPMI 1640培養液900ml中。4℃保存。
(3)完全培養液 基礎培養液中加入重組人粒細胞刺激因子至最終濃度爲每1ml含10~20ng。
(4) PBS 稱取氯化鈉8g、氯化鉀0.2g、磷酸氫二鈉1.44g、磷酸二氫鉀0.24g,加水溶解並稀釋至1000ml,經121℃、15分鐘滅菌。
(5)噻唑藍(MTT)溶液 稱取MTT粉末0.10g.溶於PBS 20ml中,配製成每1ml含5.0mg的溶液,經0.22μm濾膜過濾除菌。4℃避光保存。
(6)裂解液 量取鹽酸14ml、Triton X-100溶液50ml,加異丙醇,配製成500ml的溶液。室溫避光保存。標準晶溶液的製備 取重組人粒細胞刺激因子生物學活性測定標準品,按介紹復溶後,用基礎培養液稀釋至每1ml含50~300IU。在96孔細胞培養板中,做2倍系列稀釋,共8個稀釋度,每個稀釋度做2孔,每孔分別留50μl標準品溶液,棄去孔中多餘溶液。以上操作在無菌條件下進行。
6.2 供試品溶液的製備
將供試品按標示量復溶後,用基礎培養液稀釋成約每1ml含50~300IU。在96孔細胞培養板中,做2倍系列稀釋,共8個稀釋度,每個稀釋度做2孔,每孔分別留50μl供試品溶液,棄去孔中多餘溶液。以上操作在無菌條件下進行。
6.3 測定法
NFS-60細胞株用完全培養液於37℃、5%二氧化碳條件下培養,控制細胞濃度爲每1ml含1.0×105~4.0×105個細胞,傳代後24~36小時用於生物學活性測定。將試驗所用溶液預溫至37℃。取足量NFS-60細胞培養物,離心收集NFS-60細胞,用RPMI 1640培養液洗滌3次,然後重懸於基礎培養液配成每1ml含2.0×105個細胞的細胞懸液,置37℃備用。在加有標準品溶液和供試品溶液的96孔細胞培養板中每孔加入細胞懸液50μl,於37℃、5%二氧化碳條件下培養40~48小時。每孔加入MTT溶液20μl,於37℃、5%二氧化碳條件下培養5小時。以上操作在無菌條件下進行。每孔加入裂解液100μl,混勻後,放入酶標儀,以630nm爲參比波長,在波長570nm處測定吸光度,記錄測定結果。
試驗數據採用計算機程序或四參數迴歸計算法進行處理,並按下式計算結果:
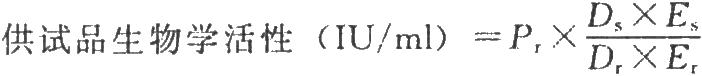
DS爲供試品預稀釋倍數;
Dr爲標準品預稀釋倍數;
ES爲供試品相當於標準品半效量的稀釋倍數;
Er爲標準品半效量的稀釋倍數。
7 附錄Ⅹ F 重組人粒細胞巨噬細胞刺激因子生物學活性測定法(TF-1細胞/MTT比色法)
本法系依據人紅細胞白血病細胞(簡稱TF-1細胞)的生長狀況因重組人粒細胞巨噬細胞刺激因子(GM-CSF)生物學活性的不同而不同.以此檢測GM-CSF的生物學活性。
7.1 試劑
(1)RPMI 1640培養液 取RPMI 1640培養基粉末1袋(規格爲1L),加水溶解並稀釋至1000ml,加青黴素105IU和鏈黴素105IU.再加碳酸氫鈉2.1g,溶解後,混勻,除菌過濾,4℃保存。
(2)基礎培養液 量取新生牛血清100ml,加入RPMI 1640培養液900ml中。4℃保存。
(3)完全培養液 基礎培養液加重組人粒細胞巨噬細胞刺激因子至終濃度爲每1ml含5.0ng或每1ml含80IU。
(4) PBS 稱取氯化鈉8g、氯化鉀0.2g,磷酸氫二鈉1.44g、磷酸二氫鉀0.24g.加水溶解並稀釋至1000ml,經121℃、15分鐘滅菌。
(5)噻唑藍(MTT)溶液 稱取MTT粉末0.10g,溶於PBS 20ml中,配製成每1ml含5mg的溶液,經0.22μm濾膜過濾除菌。4℃避光保存。
(6)裂解液 量取鹽酸14ml、Triton X-100溶液50ml,加異丙醇配製成500ml的溶液。
7.2 標準品溶液的製備
取重組人粒細胞巨噬細胞刺激因子標準品,按介紹復溶後,用基礎培養液稀釋至每1ml含10~20IU。在96孔細胞培養板中,做2倍系列稀釋,共8個稀釋度,每個稀釋度做2孔。每孔分別留50μl標準品溶液,棄去孔中多餘溶液。以上操作在無菌條件下進行。
7.3 供試品溶液的製備
將供試品按標示量復溶後,用基礎培養液稀釋成約每1ml含10~20IU。在96孔細胞培養板中,做2倍系列稀釋,共8個稀釋度,每個稀釋度做2孔。每孔分別留50μl供試品溶液,棄去孔中多餘溶液。以上操作在無菌條件下進行。
7.4 測定法
TF-1細胞株用完全培養液於37℃、5%二氧化碳條件下培養,控制細胞濃度爲每Iml含2.0×105~7.0×105個細胞,傳代後24~36小時用於生物學活性測定。將試驗所用溶液預溫至37℃。取足量TF-1細胞培養物,離心並收集TF-1細胞,用基礎培養液洗滌3次,然後重懸於基礎培養液中,配成每1ml含4.0×105個細胞的細胞懸液,置37℃備用。向加有標準品溶液和供試品溶液的96孔細胞培養板中加入細胞懸液,每孔50μl,於37℃、5%二氧化碳條件下培養48~52小時後,每孔加入MTT溶液20μl,於37℃、5%二氧化碳條件下培養5小時,以上操作在無菌條件下進行。再向上述各孔加裂解液100μl,混勻後,放入酶標儀,以630nm爲參比波長,在波長570nm處測定吸光度,記錄測定結果。
試驗數據採用計算機程序或四參數迴歸計算法進行處理,並按下式計算結果:
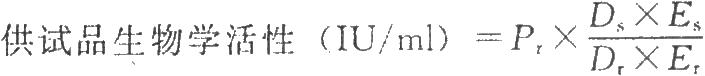
DS爲供試品預稀釋倍數;
Dr爲標準品預稀釋倍數;
ES爲供試品相當於標準品半效量的稀釋倍數;
Er爲標準品半效量的稀釋倍數。
8 附錄Ⅹ G 重組牛鹼性成纖維細胞生長因子生物學活性測定法(細胞增殖法/MTT比色法)
本法系依據重組牛鹼性成纖維細胞生長因子對小鼠胚胎成纖維細胞(Balb/c 3T3細胞)的生長具有刺激作用,Balb/c 3T3細胞的生長狀況因重組牛鹼性成纖維細胞生長因子生物學活性的不同而不同,以此檢測重組牛鹼性成纖維細胞生長因子的生物學活性。
8.1 試劑
(1) RPM11640培養液 取RPMI 1640培養基粉末1袋(規格爲1L).加水溶解並稀釋至1000ml,加青黴素105IU和鏈黴素105IU,再加碳酸氫鈉2.1g,溶解後,混勻,除菌過濾,4℃保存。
(2)維持培養液 量取新生牛血清4ml,加RPMI1640培養液至1000ml。
(3)完全培養液 量取新生牛血清100ml,加RPMI1640培養液至1000ml。
(4) PBS 稱取氯化鈉8g、氯化鉀0.2g、磷酸氫二鈉1.44g、磷酸二氫鉀0.24g,加水溶解並稀釋至1000ml,經121℃、15分鐘滅菌。
(5)噻唑藍(MTT)溶液 稱取MTT粉末0.10g,加PBS 20ml使溶解,經0.22μm濾膜過濾除菌。4℃避光保存。
8.2 標準品溶液的製備
取重組牛鹼性成纖維細胞生長因子標準品,按介紹復溶後,用維持培養液稀釋至每1ml含40IU。在96孔細胞培養板中,做4倍系列稀釋,共8個稀釋度,每個稀釋度做2孔。以上操作在無菌條件下進行。
8.3 供試品溶液的製備
將供試品按標示量復溶後,用維持培養液稀釋成每1ml約含40IU。在96孔細胞培養板中,做4倍系列稀釋,共8個稀釋度,每個稀釋度做2孔。以上操作在無菌條件下進行。
8.4 測定法
Balb/c 3T3細胞株用完全培養液於37℃、5%二氧化碳條件下培養,控制細胞濃度爲每1ml含1.0×105~5.0×105個細胞,傳代後24~36小時用於生物學活性測定。棄去培養瓶中的培養液,消化並收集細胞,用完全培養液配成每1ml含5.0×104~1.0×105個細胞的細胞懸液,接種於96孔細胞培養板中,每孔100μl,於37℃、5%二氧化碳條件下培養。24小時後換成維持培養液,於37℃、5%二氧化碳條件下培養24小時。製備的細胞培養板棄去維持液,加入標準品溶液和供試品溶液,每孔100μl,於37℃、5%二氧化碳條件下培養64~72小時。每孔加入MTT溶液20μl,於37℃、5%二氧化碳條件下培養5小時。以上步驟在無菌條件下進行。棄去培養板中的液體後,向每孔中加入二甲基亞碸100μl,混勻後,放入酶標儀,以630nm爲參比波長,在波長570nm處測定吸光度,記錄測定結果。
試驗數據採用計算機程序或四參數迴歸計算法進行處理,並按下式計算結果:
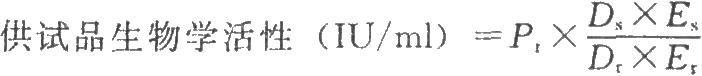
DS爲供試品預稀釋倍數;
Dr爲標準品預稀釋倍數;
ES爲供試品相當於標準品半效量的稀釋倍數;
Er爲標準品半效量的稀釋倍數。
9 附錄Ⅹ H 重組人表皮生長因子生物學活性測定法(細胞增殖法/MTT比色法)
本法系依據重組人表皮生長因子對小鼠胚胎成纖維細胞(Balb/c 3T3細胞)的生長具有刺激作用,Balb/c3T3細胞的生長狀況因重組人表皮生長因子生物學活性的不同而異,以此檢測重組人表皮生長因子的生物學活性。
9.1 試劑
(1) RPMI 1640培養液 取RPM11640培養基粉末1袋(規格爲1L),加水溶解並稀釋至1000ml,加青黴素105IU和鏈黴素105IU,再加碳酸氫鈉2.1g,溶解後,混勻,除菌過濾,4℃保存。
(2)維持培養液 量取新生牛血清4ml,加RPMI1640培養液至1000ml。
(3)完全培養液 量取新生牛血清100ml,加RPMI1640培養液至1000ml。
(4) PBS 稱取氯化鈉8g、氯化鉀0.2g、磷酸氫二鈉1.44g、磷酸二氫鉀0.24g,加水溶解並稀釋至1000ml,經121℃、15分鐘滅菌。
(5)噻唑藍(MTT)溶液 稱取MTT粉末0.10g,加PBS 20ml使溶解,經0.22μm濾膜過濾除菌。4℃避光保存。
9.2 標準品溶液的製備
取重組人表皮生長因子標準品,按介紹復溶後,用維持培養液稀釋至每1ml含50IU。在96孔細胞培養板中,做4倍系列稀釋,共8個稀釋度,每個濃度做2孔。以上操作在無菌條件下進行。
9.3 供試品溶液的製備
將供試品按標示量復溶後,用維持培養液稀釋成每1ml約含50IU。在96孔細胞培養板中,做4倍系列稀釋,共8個稀釋度,每個濃度做2孔。以上操作在無菌條件下進行。
9.4 測定法
Balb/c 3T3細胞株用完全培養液於37℃、5%二氧化碳條件下培養,控制細胞濃度爲每1ml含1.0×105~5.0×105個細胞,傳代後24~36小時用於生物學活性測定。棄去培養瓶中的培養液,消化和收集細胞,用完全培養液配成每1ml含5.0×104~8.0×104個細胞的細胞懸液,接種於96孔細胞培養板中,每孔100μl,於37℃、5%二氧化碳條件下培養。24小時後換成維持培養液,於37℃、5%二氧化碳條件下培養24小時。製備的細胞培養板棄去維持液,加入標準品溶液和供試品溶液,每孔100μl,於37℃、5%二氧化碳條件下培養64~72小時。每孔加入MTT溶液20μl,於37℃、5%二氧化碳條件下培養5小時。以上操作在無菌條件下進行。棄去培養板中的液體後,向每孔中加入二甲基亞碸100μl,混勻後在酶標儀上,以630nm爲參比波長,在波長570nm處測定吸光度,記錄測定結果。
試驗數據採用計算機程序或四參數迴歸計算法進行處理,並按下式計算結果:
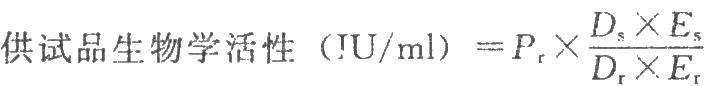
DS爲供試品預稀釋倍數;
D=爲標準品預稀釋倍數;
ES爲供試品相當於標準品半效量的稀釋倍數;
Er爲標準品半效量的稀釋倍數。
10 附錄Ⅹ I 重組鏈激酶生物學活性測定法
本法系依據鏈激酶和纖溶酶原形成的複合物能激活遊離的纖溶酶原爲有生物學活性的纖溶酶,纖溶酶能降解人纖維蛋白爲可溶性的纖維蛋白片段,在纖維蛋白平板上出現透明的溶解圈,以此定量測定重組鏈激酶的生物學活性。
10.1 試劑
(1)人凝血酶溶液 用生理氯化鈉溶液配製成每1ml含100IU,於-20℃保存。
(2)人纖溶酶原溶液 用生理氯化鈉溶液配成每1ml含0.5mg,於-20℃保存。
(3)人纖維蛋白原溶液 試驗前配製,配製前將人纖維蛋白原和備用的生理氯化鈉溶液均置37℃水浴預熱15分鐘,然後用適量生理氯化鈉溶液溶解,置37℃水浴靜置保溫30分鐘,使其完全溶解,配製成每1ml含6mg溶液待用。
10.2 標準品溶液的製備
按使用說明書,將重組鏈激酶生物學活性測定國家標準品復溶後,用生理氯化鈉溶液稀釋成每1ml含1000IU、250IU、62.5IU、15.6IU、3.9IU5個稀釋度,待用。
10.3 供試品溶液的製備
供試品按標示量加生理氯化鈉溶液復溶後,用生理氯化鈉溶液稀釋至約每1ml含100IU或1μg。
10.4 測定法
稱取瓊脂糖125mg,加生理氯化鈉溶液23ml,煮沸使之溶脹,置55~60℃水浴中平衡,加每1ml含100IU人凝血酶溶液14μl,人纖溶酶原溶液(每1ml含0.5mg) 280μl,邊加邊搖勻,加每1ml含6mg人纖維蛋白原溶液2.2ml,不停地搖勻,渾濁後立即倒入直徑8cm的平皿中,水平放置充分凝固後,4℃放置至少30分鐘待用(應在2天之內使用)。在含纖維蛋向平皿內打孔,孔徑爲2mm,在孔內分別加入供試品溶液和標準品溶液,每孔10μl,每個稀釋度做2孔,37℃溼盒水平放置24小時。縱向和橫向量取溶圈直徑,各2次,取平均值。以標準品溶液各個稀釋度的生物學活性的對數對其相應的溶圈直徑的對數作直線迴歸,求得直線迴歸方程,根據供試品的溶圈直徑的對數求得供試品的生物學活性。
11 附錄Ⅹ J 人凝血因子Ⅱ效價測定法(一期法)
本法系用人凝血因子Ⅱ缺乏血漿爲基質血漿,採用一期法測定供試品人凝血因子Ⅱ效價。
11.1 試劑
(1)稀釋液 稱取巴比妥鈉11.75g、氯化鈉14.67g,溶於適量水中,用1mol/L鹽酸溶液調pH值至7.3,再加水稀釋至2000ml。臨用前,加適量20%人血白蛋白至終濃度爲1%。
(2)含鈣促凝血酶原激酶(Thromboplastin)。
(3)人凝血因子Ⅱ缺乏血漿 人凝血因子Ⅱ含量低於1%的人血漿或人工基質血漿。
11.2 人凝血因子Ⅱ標準品溶液的製備
用人凝血因子Ⅱ缺乏血漿將標準品稀釋成每1ml含1IU凝血因子Ⅱ,再用稀釋液分別做10倍、20倍、40倍和80倍稀釋,置冰浴備用。
11.3 供試品溶液的製備
用人凝血因子Ⅱ缺乏血漿將供試品稀釋成每1ml約含1IU凝血因子Ⅱ,再用稀釋液做10倍、20倍或40倍稀釋,置冰浴待用。
11.4 測定法
量取供試品溶液0.1ml,加入凝血因子Ⅱ缺乏血漿0.1ml,混勻,置37℃水浴中保溫一定時間(一般3分鐘),然後加入已預熱至37℃的含鈣促凝血酶原激酶溶液0.2ml,記錄凝固時間。
用不同稀釋度的人凝血因子Ⅱ標準品溶液0.1ml替代供試品溶液,同法操作。
以人凝血因子Ⅱ標準品溶液效價(IU/ml)的對數對其相應的凝固時間(秒)的對數作直線迴歸,求得直線迴歸方程,計算供試品溶液人凝血因子Ⅱ效價,再乘以稀釋倍數,即爲供試品人凝血因子Ⅱ效價(IU/ml)。
11.5 【附註】
(1)直線迴歸相關係數應不低於0.98。
(2)測定時要求每個稀釋度平行測定2管,2管之差不得超過均值10%,否則重測。
12 附錄Ⅹ K 人凝血因子Ⅶ效價測定法(一期法)
本法系用人凝血因子Ⅶ缺乏血漿爲基質血漿,採用一期法測定供試品人凝血因子Ⅶ效價。
12.1 試劑
(1)稀釋液 稱取巴比妥鈉11.75g、氯化鈉14.67g,溶於適量水中.用1mol/L鹽酸溶液調pH值至7.3,再加水至2000ml。臨用前加適量20%人血白蛋白至終濃度爲1%。
(2)含鈣促凝血酶原激酶(Thromboplastin)。
(3)人凝血因子Ⅶ缺乏血漿 人凝血因子Ⅶ含量低於1%的人血漿或人工基質血漿。
12.2 人凝血因子Ⅶ標準品溶液的製備
用人凝血因子Ⅶ缺乏血漿將標準品稀釋成每1ml含1IU凝血因子Ⅷ,再用稀釋液分別做10倍、20倍、40倍和80倍稀釋,置冰浴備用。
12.3 供試品溶液的製備
用人凝血因子Ⅶ缺乏血漿將供試品稀釋成每1ml約含1IU凝血因子Ⅶ,再用稀釋液做10倍、20倍或40倍稀釋,置冰浴待用。
12.4 測定法
量取供試品溶液0.1ml,加入凝血因子Ⅶ缺乏血漿0.1ml,混勻,置37℃水浴保溫一定時間(一般3分鐘),然後加人已預熱至37℃的含鈣促凝血酶原激酶溶液0.2ml,記錄凝固時間。
用不同稀釋度的人凝血因子Ⅶ標準品溶液0.1ml替代供試品溶液,同法操作。
以人凝血因子Ⅶ標準品溶液效價(IU/ml)的對數對其相應的凝固時間(秒)的對數作直線迴歸,求得直線迴歸方程,計算供試品溶液人凝血因子Ⅶ效價,再乘以稀釋倍數,即爲供試品人凝血因子Ⅶ效價(IU/ml)。
12.5 【附註】
(1)直線迴歸相關係數應不低於0.98。
(2)測定時要求每個稀釋度平行測定2管,2管之差不得超過均值10%.否則重測。
13 附錄Ⅹ L 人凝血因子Ⅸ效價測定法(一期法)
本法系用人凝血因子Ⅸ缺乏血漿爲基質血漿,採用一期法測定供試品人凝血因子Ⅸ效價。
13.1 試劑
(1)3.8%枸櫞酸鈉溶液 稱取無水枸櫞酸鈉9.5g,加水溶解並稀釋至250ml。
(2)咪唑緩衝液(pH 7.3) 稱取咪唑0.68g、氯化鈉1.17g,溶於100ml水中,加入0.1mol/L鹽酸溶液42.2ml,再加水稀釋至200ml,即得。
(3)稀釋液 取1體積的3.8%枸櫞酸鈉加入5體積咪唑緩衝液,混合,加適量20%人血白蛋白至終濃度爲1%。
(4)激活的部分凝血活酶(APTT)試劑。
(5)人凝血因子Ⅸ缺乏血漿 爲人凝血因子Ⅸ含量低於1%的人血漿或人工基質血漿。
(6)生理氯化鈉溶液。
(7)0.05mol/L氯化鈣溶液 稱取氯化鈣(CaCl2·2H2O) 147g,加水溶解並稀釋至1000ml,配製成1mol/L氯化鈣貯存液。臨用前,用水稀釋20倍,配製成0.05mol/L氯化鈣溶液。
13.2 人凝血因子Ⅸ標準品溶液的製備
用生理氯化鈉溶液將標準品稀釋成每1ml含1IU凝血因子Ⅸ,再用稀釋液分別做10倍、20倍、40倍和80倍稀釋,置冰浴待用。
13.3 供試品溶液的製備
若供試品中含有肝素,先用硫酸魚精蛋白中和供試品中的肝素。測定時先用生理氯化鈉溶液稀釋成每1ml約含1IU凝血因子Ⅸ,再用稀釋液做10倍、20倍或40倍稀釋,置冰浴待用。
13.4 測定法
取激活的部分凝血活酶試劑0.1ml,置37℃水浴中保溫一定時間(一般4分鐘),加入凝血因子Ⅸ缺乏血漿0.1ml、供試品溶液0.1ml,混勻,置37℃水浴中保溫一定時間(一般5分鐘),加入已預熱至37℃的0.05mol/L氯化鈣溶液0.1ml,記錄凝固時間。
用不同稀釋度的人凝血因子Ⅸ標準品溶液0.1ml替代供試品溶液,同法操作。
以人凝血因子Ⅸ標準品溶液效價(IU/ml)的對數對其相應的凝固時間(秒)的對數作直線迴歸,求得直線迴歸方程,計算供試品溶液人凝血因子Ⅸ效價,再乘以稀釋倍數,即爲供試品人凝血因子Ⅸ效價(IU/ml)。
13.5 【附註】
(1)直線迴歸相關係數應不低於0.98。
(2)測定時要求每個稀釋度平行測定2管,2管之差不得超過均值10%,否則重測。
14 附錄Ⅹ M 人凝血因子Ⅹ效價測定法(一期法)
本法系用人凝血因子Ⅹ缺乏血漿爲基質血漿,採用一期法測定供試品人凝血因子Ⅹ效價。
14.1 試劑
(1)稀釋液 稱取巴比妥鈉11.75g、氯化鈉14.67g,溶於適量水中,用1mol/L鹽酸溶液調pH值至7.3,再加水稀釋至2000ml。臨用前加適量20%人血白蛋白至終濃度爲1%。
(2)含鈣促凝血酶原激酶(Thromboplastin)。
(3)人凝血因子Ⅹ缺乏血漿 人凝血因子Ⅹ含量低於1%的人血漿或人工基質血漿。
14.2 人凝血因子Ⅹ標準品溶液的製備
用人凝血因子Ⅹ缺乏血漿將標準品稀釋成每1ml含1IU凝血因子X,再用稀釋液分別做10倍、20倍、40倍和80倍稀釋,置冰浴備用。
14.3 供試品溶液的製備
用人凝血因子Ⅹ缺乏血漿將供試品稀釋成每1ml約含1IU凝血因子Ⅹ,再用稀釋液做10倍和20倍或40倍稀釋,置冰浴待用。
14.4 測定法
取供試品溶液0.1ml,加入凝血因子Ⅹ缺乏血漿0.1ml,混勻,置37℃水浴中保溫一定時間(一般3分鐘),然後加入已預熱至37℃的含鈣促凝血酶原激酶溶液0.2ml,記錄凝固時間。
用不同稀釋度的人凝血因子Ⅹ標準品溶液0.1ml替代供試品溶液,同法操作。
以人凝血因子Ⅹ標準品溶液效價(IU/ml)的對數對其相應的凝固時間(秒)的對數作直線迴歸,求得直線迴歸方程,計算供試品溶液人凝血因子Ⅹ效價,再乘以稀釋倍數,即爲供試品人凝血因子Ⅹ效價(IU/ml)。
14.5 【附註】
(1)直線迴歸相關係數應不低於0.98。
(2)測定時要求每個稀釋度平行測定2管,2管之差不得超過均值10%,否則重測。
15 附錄Ⅹ N 人凝血因子Ⅷ效價測定法(一期法)
本法系用人凝血因子Ⅷ缺乏血漿爲基質血漿,採用一期法測定供試品人凝血因子Ⅷ效價。
15.1 試劑
(1)3.8%枸櫞酸鈉溶液 稱取無水枸櫞酸鈉9.5g,加水溶解並稀釋至250ml。
(2)咪唑緩衝液(pH 7.3) 稱取咪唑0.68g和氯化鈉1.17g,加水使溶解成100ml,加入0.1mol/L鹽酸溶液42.2ml.再加水稀釋至200ml,即得。
(3)稀釋液 取1體積的3.8%枸櫞酸鈉加入5體積咪唑緩衝液混合,加適量20%人血白蛋白至終濃度爲1%。
(4)激活的部分凝血活酶(APTT)試劑。
(5)人凝血因子Ⅷ缺乏血漿 爲人凝血因子Ⅷ含量低於1%的人血漿或人工基質血漿。
(6)0.05mol/L氯化鈣溶液 稱取氯化鈣(CaCl2·2H2O) 147g,加水溶解並稀釋至1000ml,配製成1mol/L氯化鈣貯存液。用前用水稀釋20倍,配製成0.05mol/L氯化鈣溶液。
15.2 人凝血因子Ⅷ標準品溶液的製備
用人凝血因子Ⅷ缺乏血漿將標準品稀釋成每1ml含1IU凝血因子Ⅷ,再用稀釋液分別做10倍、20倍、40倍和80倍稀釋,置冰浴待用。
15.3 供試品溶液的製備
用人凝血因子Ⅷ缺乏血漿將供試品稀釋成每1ml約含1IU凝血因子Ⅷ,再用稀釋液做10倍和20倍或40倍稀釋,置冰浴待用。
15.4 測定法
取激活的部分凝血活酶試劑0.1ml,置37℃水浴保溫一定時間(一般4分鐘),加人凝血因子Ⅷ缺乏血漿0.1ml、供試品溶液0.1ml,混勻,置37℃水浴中保溫一定時間(一般5分鐘),加入已預熱至37℃的0.05mol/L氯化鈣溶液0.1ml,記錄凝固時間。
用不同稀釋度的人凝血因子Ⅷ標準品溶液0.1ml替代供試品溶液,同法操作.
以人凝血因子Ⅷ標準品溶液效價(IU/ml)的對數對其相應的凝固時間(秒)的對數作直線迴歸,求得直線迴歸方程。計算供試品溶液人凝血因子Ⅷ效價,再乘以稀釋倍數,即爲供試品人凝血因子Ⅷ效價(IU/ml)。
15.5 【附註】
(1)直線迴歸相關係數應不低於0.98。
(2)測定時要求每個稀釋度平行測定2管,2管之差不得超過均值10%,否則重測。
16 附錄Ⅹ O 人免疫球蛋白中白喉抗體效價測定法
本法系依據綿羊紅細胞經醛化和鞣酸化處理後,具有較強的吸附蛋白質的能力,能將白喉類毒素吸附於紅細胞表面上,若遇到供試品中相應抗體,會發生抗原抗體結合,產生特異性凝集,通過比較凝集反應終點測定供試品中白喉抗體效價。
16.1 試劑
(1)1%兔血清生理氯化鈉溶液 無菌採集兔全血,分離血清.置56℃,30分鐘滅能。取0.5ml兔血清加49.5ml生理氯化鈉溶液,混勻。
(2)白喉抗體診斷紅細胞懸液 用1%兔血清生理氯化鈉溶液復溶凍幹白喉抗體診斷紅細胞至5%懸液。
16.2 白喉抗體標準品溶液的製備
用1%兔血清生理氯化鈉溶液將白喉抗體標準品稀釋至每1ml含0.2HAU。
16.3 供試品溶液的製備
16.4 測定法
在UV型斑凝板上,用1%兔血清生理氯化鈉溶液將供試品溶液做2倍系列稀釋,每孔留25μl,再向每孔加25μl白喉抗體診斷紅細胞懸液,置振盪器混勻30~60秒,放溼盒內37℃結合1小時。
在UV型衄凝板上,用1%兔血清生理氯化鈉溶液將白喉抗體標準品溶液做2倍系列稀釋,每孔,留25μl,自“再向每孔加25μl白喉抗體診斷紅細胞懸液”起,同法操作。在UV型血凝板上,加1%兔血清生理氯化鈉溶液25μl,自“再向每孔加25μl白喉抗體診斷紅細胞懸液”起,同法操作,爲陰性對照。
陰性對照孔呈典塑的“-”,否則試驗不成立,應重試。以出現“++”爲判定終點,按下式計算供試品白喉抗體效價:
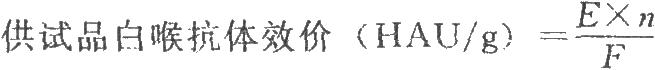
式中E爲出現“++”的最高稀釋倍數的標準品的白喉抗體效價,HAU/ml;
n爲出現“++”的供試品的最高稀釋倍數;
16.5 【附註】
(1)判定標準
17 附錄Ⅹ P 人免疫球蛋白Fc段生物學活性測定法
本法系依據特異性抗體(免疫球蛋白)Fab段與紅細胞上已包被的相應抗原結合,抗體暴露出Fc段補體C1q的結合位點,從而激活後續的補體各成分,最終導致紅細胞的細胞膜受到攻擊、破裂,釋放出血紅蛋白。通過溶血反應動力學曲線,計算人免疫球蛋白激活補體活性的功能指數(IFc),以此測定供試品Fc段生物學活性。
17.1 試劑
(1)PBS(pH7.2) 稱取無水磷酸氫二鈉1.02g、無水磷酸二氫鈉0.34g、氯化鈉8.77g,加適量水溶解,用1mol/L氫氧化鈉溶液或鹽酸溶液調pH值至7.2,再加水稀釋至1000ml。
(2)鈣-鎂貯備液 稱取氯化鈣1.10g、氯化鎂5.08g,加水25ml使溶解。
(3)巴比妥-鈣鎂貯備液 稱取氧化鈉51.85g、巴比妥鈉6.37g,加水1000ml使溶解,加入鈣-鎂貯備液3.125ml,用1mol/L鹽酸溶液調pH值至7.3,再加水稀釋至1250ml。除菌過濾後4℃保存備用。
(4)牛白蛋白-巴比妥緩衝液 稱取牛血清白蛋白0.15g於巴比妥貯備液20ml中,加水溶解並稀釋至100ml。臨用前配製。
A液 稱取鞣酸1mg,加PBS (pH7.2) 10ml,使溶解;
B液 量取A、液0.1ml,加PBS (pH7.2) 7.5ml,混勻,即得,臨用前配製。
(6)10%氯化鉻溶液 稱取氯化鉻5g,加生理氯化鈉溶液50ml使溶解。4℃保存(可保存半年)。
(7) 1%氯化鉻溶液 取10%氯化鉻溶液0.1ml,加生理氯化鈉溶液0.9ml,混勻。臨用前配製。
17.2 敏化紅細胞的製備
A液 取健康人抗凝的O型血3人份以上混合,用PBS洗滌3次,最後一次以每分鐘2000轉離心10分鐘分離紅細胞。取適量壓積紅細胞懸浮於1.3mg/L鞣酸PBS(1:40),置37℃水浴中輕搖30分鐘後再用PBS洗滌3次,最後用PBS製備成2.5%紅細胞懸浮液。
B液 用PBS適當稀釋的白喉類毒素或腮腺炎病毒與1%氯化鉻溶液0.25ml混合(10:1)後,置37℃水浴中輕搖15分鐘。
將A液、B液按1:4混合,置37℃水浴中輕搖30分鐘。離心,去上清液,用PBS將沉澱(敏化紅細胞)洗滌3次,用牛白蛋白-巴比妥緩衝液懸浮紅細胞,調節至適宜濃度,使其在波長541nm處的吸光度爲1.0±0.1。參考品溶液的製備 用1mol/L氫氧化鈉溶液將參考品pH值調節至6.8~7.0,再用牛白蛋白-巴比妥緩衝液將參考品IgG濃度稀釋至每1ml含40mg。
17.3 供試品溶液的製備
用1mol/L氫氧化鈉溶液將供試品pH值調至6.8~7.0,再用牛白蛋白-巴比妥緩衝液將供試品IgG濃度稀釋至每1ml含40mg。
17.4 測定法
取供試品溶液0.9ml,加敏化紅細胞懸液0.1ml,混勻,置37℃水浴中輕搖30分鐘。離心,去上清液,用牛白蛋白-巴比妥緩衝液1ml洗滌紅細胞,共洗3次。末次離心後棄上清液800μl,向沉澱中加入600μl預熱到37℃的牛白蛋白-巴比妥緩衝液,充分混勻,2分鐘後再加入已稀釋至每1ml含150 CH50的補體200μl,混勻後立即照紫外-可見分光光度法(2010年版藥典三部附錄Ⅱ A)在波長541nm處測定起始吸光度(AS),之後,每隔1分鐘測定1次,即得供試品在波長541nm處的吸光度與時間的溶血反應動力學曲線。當吸光度越過了曲線的內曲點後即可停止測量。分別取參考品及陰性對照(牛白蛋白-巴比妥緩衝液)0.9ml,自“加敏化紅細胞懸液0.1ml”起,同法操作。按公式(1)分別計算出參考品、供試品和陰性對照曲線斜率。按公式(2)計算供試品激活補體的功能指數(IFc):

式中 S'爲用AS修正Sexp得到的曲線斜率;
AS分別爲供試品、參考品、陰性對照在波長541nm處測定的起始吸光度;
Sexp分別爲根據供試品、參考品及陰性對照各自的溶血反應動力學曲線分別計算出的相鄰3點間的曲線最大斜率;
S'S爲供試品曲線斜率;
S'r爲參考品曲線斜率;
S'c爲陰性對照曲線斜率。
18 附錄Ⅹ Q 抗人T細胞免疫球蛋白效價測定法(E玫瑰花環形成抑制試驗)
本法系依據抗人T細胞免疫球蛋白與人淋巴細胞E受體結合後,可阻止綿羊紅細胞與淋巴細胞E受體特異性結合,根據其結合抑制率測定供試品抗人T淋巴細胞免疫球蛋白效價。
18.1 試劑
(2) Hank's液。
(3)20%胎牛血清Hank's液 試驗當天取適量滅菌的Hank's液,加入經56℃、30分鐘滅能及羊紅細胞吸收過的胎牛血清,配成20%濃度。用0.5mol/L碳酸氫鈉溶液或稀鹽酸調pH值至7.2~7.4。
(4)1%羊紅細胞懸液 頸靜脈採羊血於Alsever's液中,可保存2周。試驗前取適量羊紅細胞用生理氯化鈉溶液洗3次,用20%胎牛血清Hank's液配成1%羊紅細胞懸液。
(5)淋巴細胞懸液 取肝素抗凝新鮮人靜脈血加等量生理氯化鈉溶液混勻後,緩慢加至等量淋巴細胞分離液液麪上,以每分鐘2000轉離心20分鐘,吸出淋巴細胞層細胞,加適量生理氯化鈉溶液清洗,以每分鐘1200轉離心10分鐘,棄上清液,沉澱加入適量20%胎牛血清Hank's液,搖勻,爲淋巴細胞原液;用1%醋酸藍液將淋巴細胞原液稀釋20倍,鏡檢計數淋巴細胞。根據計數結果,用20%胎牛血清Hank's液將淋巴細胞原液稀釋成每1ml含5×106個淋巴細胞,即爲淋巴細胞懸液。
18.2 供試品溶液的製備
根據供試品效價,用20%胎牛血清Hank's液將供試品稀釋至幾個適宜濃度。
18.3 測定法
取供試品溶液100μl,加入淋巴細胞懸液100μl,搖勻,置37℃水浴30分鐘;加入1%羊紅細胞懸液100μl,混勻,室溫放置15分鐘。以每分鐘500轉離心5分鐘後置2~8℃過夜,每稀釋度供試品溶液做2管。次日取出各管,加入當天稀釋的0.2%臺盼藍溶液100μl,輕輕搖勻,鏡檢計數花環形成率(%)。取20%胎牛血清Hank's液100μl,加入淋巴細胞懸液100μl,自“搖勻,置37℃水浴30分鐘”起,同法操作,作對照組。計算花環抑制率(%),以花環抑制率在25%以上的供試品的最高稀釋倍數爲花環抑制效價。
19 附錄Ⅹ R 抗人T細胞免疫球蛋白效價測定法(淋巴細胞毒試驗)
本法系依據抗人T細胞免疫球蛋白與人淋巴細胞結合,在補體存在下破壞淋巴細胞,根據淋巴細胞死亡率測定供試品抗人T細胞免疫球蛋白效價。
19.1 試劑
(2) Hank's液。
(3)20%胎牛斑清Hank's液 試驗當天取適量經消毒保存的Hank's液,加入經56℃、30分鐘滅能的胎牛血清,配成20%濃度。用0.5mol/L碳酸氫鈉溶液或稀鹽酸調pH值至7.2~7.4。
(4)淋巴細胞懸液 取肝素抗凝新鮮人靜脈血加等量生理氯化鈉溶液混勻後,緩慢加至等量淋巴細胞分離液液麪上,以每分鐘2000轉離心20分鐘,吸出淋巴細胞層細胞,加適量生理氯化鈉溶液清洗,以每分鐘1200轉離心10分鐘,棄上清液,沉澱加入適量20%胎牛血清Hank's液,搖勻,爲淋巴細胞原液;用1%醋酸藍液將淋巴細胞原液稀釋20倍,鏡檢計數淋巴細胞。根據計數結果,用20%胎牛斑清Hank's液將淋巴細胞原液稀釋成每1ml含5×106個淋巴細胞,即爲淋巴細胞懸液。
(5)補體 採用正常家兔血清。作補體用的兔血清應對試驗用的靶細胞無明顯的毒性,因此家兔血清要預先進行選擇,方法如下:取淋巴細胞懸液0.05ml,加1:5稀釋的家兔血清0.05ml,置37℃、1小時後,加0.5%臺盼藍生理氯化鈉溶液0.05ml,置37℃、5分鐘後鏡檢計數淋巴細胞,死亡細胞率在10%以下者方可作補體用。
(6)0.5%臺盼藍生理氯化鈉溶液。
19.2 供試品溶液的製備
根據供試品效價,用20%胎牛血清Hank's液將供試品稀釋至幾個適宜濃度。
19.3 陽性對照溶液的製備
將經人T淋巴細胞免疫的豬血漿或兔血清在60℃加熱10分鐘後,用生理氯化鈉溶液稀釋10倍。
19.4 陰性對照溶液的製備
將正常豬血漿或兔血清在60℃加熱10分鐘後,用生理氯化鈉溶液稀釋10倍。
19.5 測定法
取供試品溶液0.05ml,加淋巴細胞懸液0.05ml,置37℃、1小時,加1:5稀釋的家兔血清0.05ml,置37℃、30分鐘後加0.5%臺盼藍生理氯化鈉溶液0.05ml,置37℃、5分鐘,立即鏡檢計數淋巴細胞,計算死亡細胞率,一般數100個淋巴細胞。取陽性對照溶液0.05ml,加淋巴細胞懸液0.05ml,自“置37℃、1小時”起,同法操作,作陽性對照。取陰性對照溶液0.05ml,加淋巴細胞懸液0.05ml,自“置37℃、1小時”起,同法操作,作陰性對照。
19.6 結果判定
陽性對照組的死亡淋巴細胞率大於20%,且陰性對照組的死亡淋巴細胞率小於10%,試驗成立。以(+)爲判定終點,出現(+)供試品的最高稀釋度爲該供試品的淋巴細胞毒效價。
19.7 【附註】
(1)試驗組死亡淋巴細胞率
小於10%(-)
41%~60%(++)
10%~20%(±)
61%~80%(+++)
21%~40%(+)
不低於81%(++++)
(2)如供試品較多或來不及看結果時,爲避免試驗誤差,可在抗原、抗體、補體作用後加0.5%臺盼藍生理氯化鈉溶液0.05ml,置37℃、5分鐘後,立即加2.5%戊二醛溶液0.05ml,留待適當時候鏡檢;或先加2.5%戊二醛溶液0.05ml,室溫放置10分鐘後,加入0.5%臺盼藍生理氯化鈉溶液0.05ml,置37℃,5分鐘後留待適當時候鏡檢。
20 附錄Ⅹ S 甲型肝炎滅活疫苗體外相對效力檢查法
本法系以酶聯免疫法測定供試品中的甲型肝炎病毒抗原含量,並以參比疫苗爲標準,計算供試品的相對效力。
20.1 參比疫苗及供試品溶液製備
將參比疫苗與供試品採用適宜方法進行解離後,用相應供試品稀釋液進行倍比稀釋,取1:2、1:4、1:8、1:16、1:32或其他適宜5個稀釋度進行測定。
20.2 測定法
用純化的甲肝病毒抗體包被酶標板,每孔100μl,2~8℃放置過夜,然後洗板、拍幹。用10%牛血清PBS溶液進行封閉,每孔200μl,37℃孵育1小時。
取已包被的酶標板,加入各稀釋濃度的參比疫苗和供試品,每個稀釋度加3孔,每孔100μl,37℃孵育1小時或2~8℃過夜,洗板後加酶結合物,每孔加100μl,37℃孵育1小時。
洗板後加顯色液,每孔100μl,37℃孵育10~15分鐘,加終止劑50μl,讀取吸光度(A)。
20.3 結果計算
將測出的參比疫苗及供試品的A均值乘以1000後記錄於下表。[1]
稀釋度 | 供試品A值×1000 (S) | 參比疫苗A值×1000 (T) |
1:2 1:4 1:8 1:16 1:32 | T5 T4 T3 T2 T1 | S5 S4 S3 S2 S1 |
供試品抗原含量=參比疫苗抗原含量×antilg(V/W×lg2)
V=O.2 (T1+T2+T3+T4+T5)-0.2(S1+S2+S3+S4+S5)
W=0.1(T5-T1+S5-S1)+0.05(T4-T2+S4-S2)
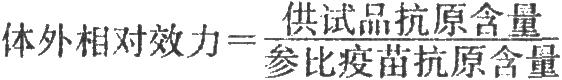
21 參考資料
- ^ [1] 國家藥典委員會.中華人民共和國藥典:2010年版:第一增補本[M].北京:中國醫藥科技出版社,2010.