1 拼音
jīn miǎn yì jì shù
金免疫技術在70年代初期由Faulk和Taylor始創,最初用於免疫電鏡技術。迄今爲止,金標記仍主要用於免疫組織化學中。金免疫技術的特點是以膠體金作爲標記物。在免疫測定中,金標記常與膜載體配合,形成特定的測定模式,典型的如斑點免疫滲濾試驗和斑點免疫層析試驗等,已是目前應用廣泛的簡便、快速檢驗方法。
2 膠體金的特性和製備
2.1 膠體金的結構
膠體金(colloidalgold)也稱金溶膠(goldsol),是由金鹽被還原成原金後形成的金顆粒懸液。膠體金顆粒由一個基礎金核(原子金Au)及包圍在外的雙離子層構成,緊連在金核表面的是內層負離子(AuC12-),外層離子層H+則分散在膠體間溶液中,以維持膠體金遊離於溶膠間的懸液狀態。
膠體金顆粒的基礎金核並非是理想的圓球核,較小的膠體金顆粒基本是圓球形的,較大的膠體金顆粒(一般指大於30nm以上的)多呈橢圓形。在電子顯微鏡下可觀察膠體金的顆粒形態。
2.2 膠體金的特性
1.膠體性質膠體金顆粒大小多在1~100nm,微小金顆粒穩定地、均勻地、呈單一分散狀態懸浮在液體中,成爲膠體金溶液。膠體金因而具有膠體的多種特性,特別是對電解質的敏感性。電解質能破壞膠體金顆粒的外周永水化層,從而打破膠體的穩定狀態,使分散的單一金顆粒凝聚成大顆粒,而從液體中沉澱下來。某些蛋白質等大分子物質有保護膠體金、加強其穩定性的作用。
2.呈色性微小顆粒膠體呈紅色,但不同大小的膠體呈色有一定的差別。最小的膠體金(2~5nm)是橙黃色的,中等大小的膠體金(10~20nm)是酒紅色的,較大顆粒的膠體金(30~80nm)則是紫紅色的。根據這一特點,用肉眼觀察膠體金的顏色可粗略估計金顆粒的大小。
3.光吸收性膠體金在可見光範圍內有一單一光吸收峯,這個光吸收峯的波長(λmax)在510~550nm範圍內,隨膠體金顆粒大小而變化,大顆粒膠體金的λmax偏向長波長,反之,小顆粒膠體金的λmax則偏於短波長,表19-1所列爲部分膠體金的λmax。
2.3 膠體金的製備
1.製備方法膠體金的製備多采用還原法。氯金酸(HauC14)是主要還原材料,常用還原劑有檸檬酸鈉、鞣酸、抗壞血酸、白磷、硼氫化鈉等。根據還原劑類型以及還原作用的強弱,可以製備0.8nm~150nm不等的膠體金。最常用的製備方法爲檸檬酸鹽還原法。具體操作方法如下:
(1)將HauC14先配製成0.01%水溶液,取100ml加熱至沸。
(2)攪動下準確加入一定量的1%檸檬酸三鈉(Na3C6H5O7·2H2O)水溶液。
(3)繼續加熱煮沸15min。此時可觀察到淡黃色的氯金酸水溶液在檸檬酸鈉加入後很快變灰色,續而轉成黑色,隨後逐漸穩定成紅色。全過程約2~3min。
(4)冷卻至室溫後用蒸餾水恢復至原體積。
用此法可製備16~147nm粒徑的膠體金。金顆粒的大小取決於製備時加入的檸檬酸三鈉的量。表19-1列舉製備4種不同粒徑膠體金時檸檬酸三鈉的用量。
表19-1 四種粒徑膠體金的製備及特性
*還原100ml0.01%HauC14所需量
2.注意事項
(2)氯金酸對金屬有強烈的腐蝕性,因此在配製氯金酸水溶液時,不應使用金屬藥匙稱量氯金酸。
(3)用於製備膠體金的蒸餾水應是雙蒸餾水或三蒸餾水,或者是高質量的去離子水。
(4)是以製備膠體金的玻璃容器必須是絕對清潔的,用前應先經酸洗並用蒸餾水衝淨。最好是經硅化處理的,硅化方法可用5%二氯甲硅烷的氯仿溶液浸泡數分鐘,用蒸餾水衝淨後乾燥備用。
(5)膠體金的鑑定和保存:膠體金的製備並不難,但要制好高質量的膠體金卻也並非易事。因此對每次制好的膠體金應加以檢定,主要檢查指標有顆粒大小,粒徑的均一程度及有無凝集顆粒等。
肉眼觀察是最基本也是最簡單和方便的檢定方法,但需要一定的經驗。良好的膠體金應該是清亮透明的,若製備的膠體金混濁或液體表面有漂浮物,提示此次製備的膠體金有較多的凝集顆粒。在日光下仔細觀察比較膠體金的顏色,可以粗略估計製得的金顆粒的大小。當然也可用分光光度計掃描λmax來估計金顆粒的粒徑。結制備的膠體金最好作電鏡觀察,並選一些代表性的作顯微攝影,可以比較精確地測定膠體金的平均粒徑。
膠體金在潔淨的玻璃器皿中可較長時間保存,加入少許防腐劑(如0.02%NaN3)可有利於保存。保存不當時會有細菌生長或有凝集顆粒形成。少量凝集顆粒並不影響以後膠體金的標記,使用時爲提高標記效率可先低速離心去除凝集顆粒。
3 免疫金的特性和製備
3.1 免疫金的特性
膠體金可以和蛋白質等各種大分子物質結合,在免疫組織化學技術中,習慣上將膠體金結合蛋白質的複合物稱爲金探針。用於免疫測定時膠體金多與免疫活性物質(抗原或抗體)結合,這類膠體金結合物常稱爲免疫金複合物,或簡稱免疫金(immunogold)。
膠體金與蛋白質結合的機制尚有十分清楚,一般認爲是物理吸附性的。膠體金顆粒帶有一層表面陰性電荷,與蛋白質表面的陽性電荷通過靜電感應相附。因此環境pH和離子強度是影響吸附的主要因素,其他如膠體金顆粒的大小、蛋白質的分子量及蛋白質濃度等也會影響蛋白質的吸附。
3.2 免疫金的製備
1.用0.2mol/LK2CO3或0.1mol/LHC1調節膠體金溶液的pH至選定值。原則上可選擇待標記蛋白質等電點,也可略爲偏鹼。但通常最適反應pH往往需經多次試驗才能確定。
在調節膠體金的pH值時應注意,膠體金會阻塞pH計的電極,不可直接將電極插入膠體金溶液中,宜先用終濃度爲0.15的聚乙二醇(PEG,20000)穩定膠體金後,再膠體金的pH值。
2.將1/10體積的合適濃度的蛋白質溶液加於膠體金溶液中,放置室溫反應2~5min。
由於鹽類成分能影響膠體金對蛋白質的吸附,並可使膠體金聚沉,因此待標記蛋白質溶液若含有較高的離子濃度,應在標記前先對低離子強度的蒸餾水透析去鹽。
3.加入濃度爲0.2%的PEG或BSA以飽和遊離的膠體金。
4.離心分離,去除上清液中未結合的蛋白質。離心條件視膠體金顆粒的粒徑而異:對5nm金顆粒可選用40000r/min離心1h;8nm金顆粒用25000r/min離心45min;14nm金顆粒用25000r/min離心30min,40nm金顆粒用15000r/min離心30min。
5.輕吸上清液。沉澱用含PEG或BSA的緩衝液懸浮,恢復原體積後再離心。如此洗滌2~4次。以徹底除去未結合的蛋白質。
6.免疫金複合物最終用稀釋液配製成工作濃度保存。稀釋液通常是加入穩定劑的緩衝液。緩衝溶液常用中性的PBS或Tris緩衝液。
多種蛋白質、葡聚糖、PEG2000、明膠等均爲良好的高分子穩定劑,PEG和BSA是最常用的穩定劑。穩定劑有兩大作用:一爲保護膠體金的穩定性,使之便於長期保存;二爲防止或減少免疫金複合物的非特異性吸附反應。穩定劑的合理選擇是十分重要的,不適當的穩定劑有時也會導致非特異性反應。
4 金免疫測定
斑點金免疫滲濾試驗和斑點免疫層析試驗是在斑點-ELISA和RIBA兩種斑點免疫結合試驗基礎上發展形成的,均以硝酸纖維素膜爲固相載體,以免疫金爲結合物。因其最大特點是簡便快速,故統稱爲快速斑點免疫結合試驗。
4.1 斑點金免疫滲濾試驗
斑點免疫滲濾試驗的基本原理是:以硝酸纖維素膜爲載體,利用微孔濾膜的可濾過性,使抗原抗體反應和洗滌在一特殊的滲濾裝置上以液體滲濾過膜的方式迅速完成。斑點免疫滲濾試驗最初是從斑點ELISA基礎上發展起來建立的,應用的結合物是酶標記的,稱爲斑點酶免疫滲濾試驗。90年代初發展了以膠體金爲標記物的斑點免疫滲濾試驗(dotymmunogoldfiltrationassay,DIGFA),又名滴金免疫測定法(簡稱滴金法)。在滴金法中不需酶對底物的反應,更加簡便、快速,在臨牀檢驗中應用日漸廣泛。
4.1.1 (一)原理
以雙抗體夾心法爲例。在硝酸纖維素膜的膜片中央滴加純化的抗體,爲膜所吸附。當滴加在膜上的標本液體滲濾過膜時,標本中含抗原被膜上抗體捕獲,其餘無關蛋白等沒濾出膜片。其後加入的膠體金標記也在滲濾中與已結合在膜上的抗原相結合。因膠體金本身呈紅色,陽性反應即在膜中央顯示紅色斑點。
4.1.2 (二)試劑和操作
1.滲濾裝置滲濾裝置是滴金法測定中的主要試劑成分之一,由塑料小盒、吸水墊料和點加了抗原或抗體的硝酸纖維素膜片三部分組成。塑料小盒可以是多種形狀的,盒蓋的中央有一直徑約0.4~0.8cm的小圓孔,盒內墊放吸水墊料,硝酸纖維素膜片安放在正對盒蓋的中央有一直徑約0.40.8cm的小圓孔,盒的墊放吸水塑料,硝酸纖維素膜片安放在正對盒的圓孔下,緊密關閉盒蓋,使硝酸纖維素膜片貼緊吸水墊料。如此即製備成一滲濾裝置(圖19-1)。塑料小盒的形狀最多見的是扁平的長方形小板,加之滴金法的整個反應過程都是在滲濾裝置上進行的,因此又常稱滲濾裝置爲滴金法反應板。
2.試劑盒組成滴金法試劑盒的三個基本試劑成分是滴金法反應板、免疫金複合和洗滌液。爲了提供質控保證,用於抗原測定的試劑盒還應包括抗原參照品,相應的檢測抗體的試劑盒應有陽性對照品。
3.測定操作以雙抗體夾心法爲例,具體步驟如下:
(1)將反應板平放於實驗臺上,於小孔內滴加血清標本1~2滴,待完全滲入。
(4)判讀結果:在膜中央有清晰的淡紅色斑點顯示者判爲陽性反應;反之,則爲陰性反應。斑點呈色的深淺相應地提示陽性強度。
4.1.3 (三)質量控制
滴金法的質量控制常採用在硝酸纖維素膜上點加質控點的方法。質控小圓點多位於反應斑點的正下方。雙抗體夾心法的質控點最好是相應抗原,若該抗原試劑不易製備或價格昂貴時,也可用SPA或針對金標抗體的抗抗體來充當。間接法的質控點採用鹽析法粗提的人IgG最爲經濟、方便。

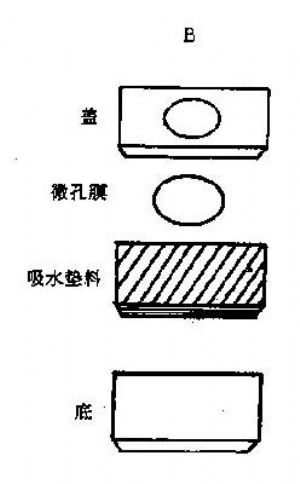
圖19-1 DIGFA滲濾裝置及操作示意圖
A:操作示意圖B:裝置分解圖
有將包被斑點由圓點改成短線條式的:質控斑點橫向包被成橫線條,如“-”;反應斑點縱向包被成豎線條,如“∣”;兩者相交成“+”。這樣,陽性反應結果在膜上顯示紅色的正號(+),陰性反應結果則爲負號(-),目視判斷直觀、明瞭。
4.2 斑點免疫層析試驗
4.2.1 (一)原理
斑點免疫層析試驗(dotimmunochromatographicassay,DICA)簡稱免疫層析試驗(ICA),也以硝酸纖維素膜爲載體,但利用了微孔膜的毛細血管作用,滴加在膜條一端的液體慢慢向另一端滲移,猶如層析一般。
4.2.2 (二)試劑和操作
免疫層析試驗以單克隆雙抗體夾心法爲例。試驗所用試劑全部爲幹試劑,多個試劑被組合在一個約6mm×70mm的塑料板條上,成爲一單一試劑條(圖19-2),試劑條上端(A)和下端(B)分別粘貼吸水材料,免疫金複合物乾片粘貼在近下端(C)處,緊貼其上爲硝酸纖維素膜條。硝酸纖維素膜條上有兩個反應區域,測試區(T)包被有特異抗體,參照區(R)包被有抗小鼠IgG。

測定時將試紙條下端浸入液體標本中,下端吸水材料即吸取液體向上端移動,流經C處時使乾片上的免疫金複合物復溶,並帶動其向膜條滲移。若標本中有待測特異抗原,其時可與免疫金複合物之抗體結合,此抗原抗體複合物流至測試區即被固相抗體所獲,在膜上顯出紅色反應線條(T)。過剩的免疫金複合物繼續前行,至參照區與固相小鼠IgG結合(免疫金複合物中的單克隆抗體爲小鼠IgG),而顯出紅色質控線條(R)。反之,陰性標本則無反應線條,而僅顯示質控線條。
斑點免疫層析試驗在試劑形式和操作步驟上較前述的幾種免疫測定法都更爲簡化,只用一個試劑,只有一步操作。
4.3 應用
上述兩種試驗的共同特點是:簡便、快速、單份測定、可立等結果,除試劑外無需任何儀器設備,且試劑穩定。因此特別適用於急診檢驗。但這類試驗不能準確定量,所以主要限於檢測正常體液中不存在的物質(例如診斷傳染病中的抗原或抗體)以及正常含量極低而在特殊情況下異常升高的物質(如HCG等)。目前臨牀檢驗中已開展的項目有HCG、抗HCV和抗HIV等。新項目正在不斷髮展中。
5 免疫金銀染色
免疫金銀染色(immunogoldsilverstaining,IGSS)是在金免疫技術基礎上發展起來的更爲敏感的技術,由Holgate在1983年首先建立成功。
5.1 原理
金免疫技術測定的產物上的金顆粒可將銀離子還原成銀顆粒,在金顆粒表面形成一色澤更深的黑色層,因而增強了金免疫技術的敏感性(圖19-3)。
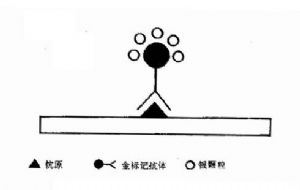
圖19-3 免疫金銀染色原理示意圖
5.2 方法
IGSS的主要試劑爲銀染液。以往一般用硝酸銀染液,但其對光的穩定性較差;改用乙酸銀溶液後穩定性加強,配方如下:
A液:0.22%乙酸銀溶液(乙酸銀110mg溶於去離子水50ml中)。
B液:50%阿拉伯樹膠溶液(阿拉伯樹膠50g溶於去離子水100ml中,每天振搖3次,5天后過濾使用)。
C液:1%對苯二酚溶液(對苯二酚500mg溶於0.55mol/LpH3.8的檸檬酸鹽緩衝液50ml中)。
D液:在C液中加入B液10~40ml。
使用前將A液和D液等量混合,即爲銀染液。
IGSS多用於組織化學檢測。對於以膜爲載體的免疫學試驗,金染色後的銀加強可按下法進行:將膜用0.05mol/LpH8.2TBS浸洗3次,每次3min,用去離子水沖洗一次,浸入0.05mol/LpH3.8檸檬酸緩衝液平衡5min,浸入銀染液中,37℃25min。將膜取出,用去離子水沖洗,放入定影液1min,去離子水沖洗,空氣乾燥。
5.3 應用
金免疫技術的敏感度低於其它標記免疫技術,經銀加強染色後敏感度可與熒光免疫技術和酶免疫技術相當。因此近年來發展了不少IGSS方法以替代熒光免疫技術,可以在普通顯微鏡下進行檢測。
在以膜爲載體的免疫技術(如免疫印跡法)中,也有應用IGSS以替代酶免疫法。也有用金標記抗體代替酶標記抗體進行類似ELISA的測定,最後進行銀加強,其敏感度與ELISA相仿。