3 概述
宮頸復發癌是指宮頸癌經根治性治療治癒後腫瘤再現。宮頸復發癌大多發生於晚期宮頸癌(包括局部晚期)治療後,也有報告浸潤性宮頸癌治療後約有35%復發。複發性宮頸癌的治療困難,預後差,是宮頸癌死亡最重要的原因。因不同的治療手段、治療後治癒情況及臨牀表現差異而有不同的定義。
3.1 放療後復發
放療後復發是指宮頸癌經放射治療後局部腫瘤消失(包括宮頸原發腫瘤及陰道、宮旁部位浸潤竈),經一段時間(放療結束後至少3個月)宮頸創面完全癒合後,於盆腔內或遠處又發現腫瘤,則稱復發。按部位復發又分爲3類:①中心性復發(包括宮頸、陰道或宮體);②宮旁復發(包括盆壁);③遠處復發(或轉移),即盆腔外全身不同部位的腫瘤轉移。
3.2 手術後復發
手術後復髮指宮頸癌經根治性手術徹底切除,且手術標本切緣無腫瘤,術後又出現腫瘤,則稱術後復發。
3.3 復發與未控、新發的區別
尚有兩點值得提出:
(1)治療後腫瘤未控制(簡稱未控)與腫瘤復發,實際上二者在部分病例中很難戴然區分,故有作者將“未控”納入復發癌中討論。
放療後未控是指放療結束後3個月內宮頸原發腫瘤和(或)宮旁浸潤持續存在,或盆腔內出現新的病竈。手術後未控是指根治性手術後手術野內病竈繼續存在(包括手術中腫瘤未能切除或切緣有腫瘤),或首次手術後1年內局部又有腫瘤生長。
關於放射治療後未控與復發的判斷,主要根據創面組織是否癒合而定,有些病例需結合臨牀動態觀察。目前對宮頸組織癒合的時間標準計算有以放療結束後3個月爲界(Manetta等,1992),也有從放療開始計算6個月爲界(中國醫學科學院腫瘤醫院)。
(2)宮頸晚期復發癌:是指初次治療10年後宮頸再現腫瘤,然而究竟是真的復發癌還是新發生的癌有待鑑別和討論,實質上對二者的臨牀診治分析並無影響。
病人接受了手術,如果病竈切除乾淨,但是在手術6個月後,發現有重新長出來的癌,稱之爲復發癌(recurrent carcinoma of the cervix)。如果是在手術6個月之內就發現的同樣細胞的癌,稱之爲持續存在的癌症(persistent carcinoma)。不過,也有人認爲手術時肉眼看到的癌都已切除,標本的邊緣都是乾淨的,就是沒有殘餘癌細胞,一旦發現癌症便稱復發癌。手術1年之內,在手術地方或有局部復發,都叫復發。這些說法時間上的差異都不重要。重要的是手術後又有了癌症,是持續癌或復發癌都一樣地需要面對。
8 流行病學
一般估計,不管用哪一種治療,複發率或持續癌大約在35%,而且95%以上是在手術2年之內發生的。此外,依FIGO的分期,愈是早期,複發率愈低。Larson等報告,Ⅰb的手術複發率是11%(27/249)。其中,17個病人的復發部位在骨盆腔和外陰,7個人是在骨盆腔外。骨盆腔和外陰單一復發的15個病人中,經過放療病人的無病期(tumor free interval)平均是48個月(10~26個月)。Kred等則報告40位復發癌中,11位(27.5%)是中央復發,再治療的5年存活率僅有13%。Webb等(104人)的5年存活率只有5.7%。
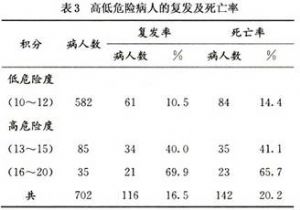
在個別的複發率中,最高的複發率前五名依次爲≥Ⅱb,50%(7/14);細胞分化差的病人,45.5%(5/11):年齡≤30的病人,44.4%(4/9);淋巴有侵犯的病人,40.8%(51/125),子宮旁侵犯,37.65%(38/101),見表1。其中只有淋巴和子宮旁沒有癌細胞的侵犯,具統計上的意義外,其餘三個因素因病人數太少,雖有差別,並無意義。依據這10個因素的復發數字再經過系統分析(seoringsystem),將得分≤12的病人列爲低危險病人,得分≥13的列爲高危險病人。這兩組病人,低危險病人的復發和病死率分別是10.5%和14.4%;高危險病人的復發和病死率則分別爲40.0%和41.1%以上。這個差別,有統計學的意義,P<0.05(表2,3)。


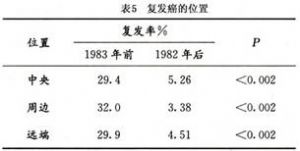
臺北榮總醫院在1982年後,經過至少3年的追蹤,90%以上是5年以上的觀察,發現Ⅰb~Ⅱa的複發率是13.3%,其中,Ⅰb是10.1%,Ⅱa是22.5%,Ⅱb的複發率是29.9%。就復發部位而言,中央復發是5.26%,周邊3.38%,遠端4.51%,見表4、5。其中,周邊也包括中央復發在內,因此數字有重疊。從這些數字可以看出,Ⅰb複發率的報道都很接近,不過中央復發可能與手術切除的範圍大小有關。以臺北榮總醫院的分析來說,自從手術經過三次修改之後,兩側也即子宮頸和陰道兩旁組織切除越多之後,複發率明顯減少,尤其是Ⅱb,由原來的55.8%降低爲29.9%。Ⅰb~Ⅱa雖也有改善,但未有統計上的意義。惟復發位置,無論是中央周邊及遠端都有明顯減少。

9 宮頸復發癌的病因
除了治療以外,影響復發的因素很多。將子宮根除術資料完整、Ⅰb~Ⅱa、追蹤5年以上的病人702位列出十種因素做個別分析,並利用電腦計分法Mantel-Cox test,因個別因素的複發率給各個因素一個分數,計分愈多,危險性愈高。在手術前及後做一個預測,評估手術後複發率並考慮輔助治療,以期減少複發率。這10個因素包括病人的年齡、FIGO分期、組織學分類、細胞分化、子宮侵犯、子宮旁侵犯、陰道侵犯、淋巴血管空隙栓塞(tumor emboli)、標本邊緣的殘留癌細胞(margin tumor)和淋巴侵犯。
目前臨牀和病理的詮釋仍有差距,並未有一致的看法。袁九重和王鵬惠等人分析1115位行子宮根除手術的病人,追蹤10年,發現個別因素雖各有獨立的意義,多重因素加起來大家都認爲的高危險因素,如子宮旁侵犯、FIGO分期以及間質層侵犯與淋巴侵犯,無論單獨和加起來比較,前三項並不重要。惟有淋巴侵犯最危險,尤其當間質層有深部侵犯(≥1/2cm),再加上淋巴有轉移,從複發率和存活率來看最有影響。淋巴血管空隙侵犯(lymph-vascular space involvement,tumor emboli)在沒有淋巴侵犯時不是一個高危險因素,與多數學者的看法有些不一樣。有淋巴轉移的深度間質侵犯病人和沒有淋巴轉移的深度間質侵犯病人比較,複發率分別是52.9%(64/121)和31.5%(51/162)(P=0.003)。這與Sevin的分析一樣,深部間質侵犯是一個高危險因素。
有研究針對淋巴侵犯,做了深度的子宮根除手術後探討。FIGOⅠb~Ⅱa的淋巴侵犯率是20.8%(288/1383),而Ⅱb病人的淋巴侵犯率是41.6%(96/231)。有淋巴侵犯的複發率是63.8%(106/288),沒有淋巴侵犯的複發率是11.0%(120/1095)。從288位有淋巴侵犯的病人當中做淋巴侵犯數目計算,發現淋巴侵犯數目在≤2的複發率是26.6%(43/164),而數目在≥3的複發率是50.8%(63/124)(P<0.0001)。66位做主動脈淋巴摘除者,沒有侵犯的是83.3%(55/66),有侵犯的是16.6%(11/66)。另外,手術時主動脈淋巴沒有腫大的,手術後發現有顯微侵犯(microscopic metastasis)者佔4.6%(1/22),有腫大的侵犯率是22.2%(8/36)。有主動脈淋巴侵犯的病人,骨盆腔淋巴都有一個以上的轉移。
這個探討說明了有淋巴侵犯尤其數目在3個以上的複發率最高,應該考慮輔助性治療(adjuvant therapy)。主動脈淋巴尤其沒有腫大的可能不考慮摘除,應該可以降低手術後的小腸阻塞和其他合併症。
10 發病機制
除了手術切除範圍影響複發率尤其是復發的位置之外,其實再大的手術也只能對侷限在子宮甚至骨盆腔裏的腫瘤做一個最大的切除。從子宮頸癌的擴散途徑看,淋巴、血液以及直接蔓延都有可能,因此復發機會難免。有學者分析84位Ⅰb~Ⅱb病人手術前血液裏癌細胞的存在,利用PCR(Feverse transeriptase-PCR)測定周邊血液鱗狀上皮子宮頸癌(SCC)的癌症指標cytokeratin 19,結果發現21.4%(18/84)呈陽性反應,與子宮頸良性疾病組的5.7%(2/35)和正常子宮頸組的0%(28)比較,有意義上的差別,顯示子宮頸癌病人的癌細胞早就出現在周邊血液裏,經由血液擴散和轉移是有可能存在的。可是呈陽性反應的病人,跟所有危險因子包括骨盆淋巴轉移等合併分析卻又無意義。也許說明了這些遊離在血中的子宮頸癌細胞不是自身存活不久,便是不容易找到存活的機會。不過,這種發現從長遠看,也許以後可以減少遠端或者撲滅經由血路的轉移。
11 宮頸復發癌的臨牀表現
隨復發部位及病變程度不同出現相應的臨牀症狀和體徵,早期可無症狀。臨牀表現是逐漸進展的。宮頸復發癌患者的主要症狀和體徵常表現爲消瘦。
11.1 中心性復發
11.2 宮旁(或盆壁)復發
宮旁(或盆壁)復發早期可有下腹不適感,隨病變發展可出現患側下肢疼痛、水腫、骶髂部(或髖部)疼痛、腰痛、下腹痛、排尿排便困難,有時可發現下腹或盆腔包塊。
11.2.1 (1)復發部位
以盆腔爲主,佔60%以上。
①宮頸癌術後復發:以陰道上段及原宮頸部位最常見,佔1/4(Graham等,1962),國內學者曾報道局部複發率爲59.8%,遠處轉移佔40.2%,其中以肺(16.9%)、鎖骨上淋巴結(12.0%)及骨、肝多見。
②放療後復發:多數報道盆腔內復發較盆外轉移爲多。Graham等(1962)報道43%發生在宮旁(包括盆壁,27%在宮頸、子宮或陰道上段,6%在陰道下2/3,16%在遠處,8%不詳)。中國醫學科學院腫瘤醫院作了一系列報道,在宮頸癌傳統放療後失敗的病例中,盆腔內復發佔70%,遠處轉移佔30%,盆外器官轉移中以肺轉移多見,佔2.4%,鎖骨上淋巴結轉移率爲1.62%,骨轉移佔0.88%,國外報道分別爲1.3%~8.9%(肺)、2.97%(鎖骨上淋巴結轉移)及5.0%(骨轉移)。20世紀80年代後隨放療設備及技術的迅速發展,Manetta等(1992)認爲中心性復發已降低,孫建衡(1993)報道腔內後裝放療後盆腔內復發降至41%,遠處轉移則佔59%。張曉春等(1995)報道宮頸癌治療後盆腔複發率僅19.7%,其中盆壁復發爲53.3%,中心性復發佔46.7%。
11.2.2 (2)復發時間
國內外多數報道60%以上發生在2年內。據中國醫學科學院腫瘤醫院統計,在宮頸癌放療後復發的95例中,發生在第一年內佔42.1%,2年內佔60%,5年後佔10.5%,10年後仍有6.3%。張曉春等(1995)報道60.8%發生在2年內,李孟達等(1992)報道宮頸癌術後復發,1年內佔36.9%,2年內佔61.9%,3年內佔72.8%,5年內佔93%以上。
11.3 遠處復發轉移
如肺轉移時有咳嗽、胸痛和(或)背痛、咳痰、痰中帶血或咯血等,骨轉移時常有固定的局竈性疼痛,肝轉移時常有肝區不適或疼痛、肝大等,鎖骨上淋巴結腫大。
11.4 惡病質晚期患者可出現全身消耗綜合徵
13 實驗室檢查
13.1 腫瘤標記物
目前對晚期及復發宮頸癌監測有意義的腫瘤標記物是鱗狀上皮癌抗原(SCC),Pectasides等(1994)報告腫瘤出現復發或進展時92%的患者SCC上升。
13.2 陰道脫落細胞學檢查
放射治療後,陰道脫落細胞找癌細胞常難於估價。從放射生物學角度看,有活力的細胞是指具有持續增長能力的細胞。無活力的細胞是指喪失增生能力的細胞,但它仍具有代謝活性。放射治療後癌細胞可持續數月酷似正常細胞,但從生物學上這些細胞無活力,因此放射治療後陰道脫落細胞塗片仍可找到癌細胞而被誤認爲腫瘤繼續擴散,同時肉眼觀察由於受放射反應亦很難鑑別,這稱爲放射作用(radiation effect)。因此,復發癌的診斷必須依賴病理檢查,切片至少要在治療結束後3個月以後進行。
14 輔助檢查
14.1 陰道鏡檢查
放射治療後,陰道鏡檢查也可看到無活力的癌細胞,誤認爲是癌復發,必須注意。因此放射治療後,因受放射反應的影響不易正確診斷。
14.2 宮頸活檢及宮頸管刮術
取組織送病理檢查是常用的一種明確診斷的方法。針刺活檢是取得組織的一種行之有效的方法,可直接穿刺病竈,或在X線透視下或在B超引導下進行。
14.3 靜脈腎盂造影、淋巴造影及X線斷層攝片
15 宮頸復發癌的診斷
宮頸復發癌的診斷必須結合臨牀、盆腔檢查及多種輔助檢查,綜合評估分析以及時發現早期診斷。
宮頸癌治療結束一段時間後出現上述症狀及體徵應警惕復發的可能,最後確診仍需根據病理組織學檢查。中心性復發經臨牀、細胞學和組織學檢查常可診斷,而宮旁及遠處轉移的診斷主要依靠病史、盆腔檢查及輔助檢查。一般認爲放療後盆腔內復發的早期診斷較爲困難,其原因可能有:①復發的某些症狀類似放療後副反應;②宮旁(或盆壁)復發常缺乏明確的客觀指標;③放療後宮頸萎縮、宮旁纖維化等影響檢查和取材;④放療後脫落細胞的放射反應性改變常被誤認爲腫瘤未控或復發,故細胞學檢查發現癌細胞時難以評估其實際的臨牀意義。
1.全身檢查 注意全身器官有無可疑病竈、淺表淋巴結有無腫大,尤其是左鎖骨上淋巴結及下肢水腫等體徵。
2.盆腔檢查 多數復發病竈是在治療後隨診時發現的。手術後窺視陰道殘端可見出血的癌竈或陰道黏膜下增厚僵硬的浸潤竈(尤其是腺癌者),或盆腔捫及包塊可診斷術後復發,後者應與術後淋巴囊腫相鑑別。對放療後復發的診斷,盆腔檢查時需注意以下幾點:
(1)放療後已愈的宮頸或陰道、外陰又出現充血、糜爛或類似肉芽狀病竈時不應忽視,須進一步檢查。中國醫學科學院腫瘤醫院章文華等(1990)報道中心性復發的病例中85.7%有此類表現。
(2)放療後宮頸萎縮或組織癒合後又出現宮頸增大、結節、不平甚至潰瘍壞死,此時應高度懷疑復發,但需與放射性壞死鑑別,後者的宮頸質地均勻一致,經陰道沖洗局部消炎等處理後會漸趨好轉。
17 宮頸復發癌的治療
17.1 宮頸復發癌的治療原則
(1)宮頸復發癌的治療極爲困難,其原因主要有:
①術後或放療後由於解剖變異、組織粘連、纖維化或已致的放射損傷等,不僅給再治療增加難度,且易發生更嚴重的併發症。
②根治性放療後復發(或未控)的再放療,無論腔內還是體外照射,盆腔組織對放療的耐受量明顯降低,合理適中的放射劑量難以掌握,因此大多皆爲姑息性治療。
③評估既往所致的放射損傷、周圍正常組織的耐受程度及預測放射敏感性等,目前尚無有效辦法。
④手術瘢痕、放療纖維化及機體免疫功能低下,影響瘤牀的化療藥物濃度、機體對化療的耐受程度及化療效果。
復發癌的治療有上述特殊性及複雜性,因此,高度個別對待及綜合治療是十分重要的,應根據復發部位和時間、腫瘤範圍及程度、初治方法、首次放療劑量及全身狀況等因素選擇不同的治療方案。儘管如此,復發轉移癌的治療仍是臨牀面臨的一大難題。
①凡術後盆腔復發者首選放射治療,若有手術切除可能時可行剖腹探查。
②放療後中心性復發者以手術治療爲主,不宜手術者可考慮是否再放療。
③放療後盆腔復發宜行以化療爲主、輔以姑息性放療的綜合治療,然而再次放療時須格外謹慎。
④遠處轉移多需綜合治療,可採取相應部位的放療、手術或以化療爲主的綜合治療。Russel等(1987)提出復發癌治療前強調對既往治療史、現病史作詳細詢問,評估以前所致的損傷及瞭解腫瘤與周圍器官的關係,因此需全面檢查,除有關的輔助檢查外,還應作鋇灌腸、全消化道造影、膀胱鏡、乙狀結腸鏡等,重視這些檢查的結果,以考慮再治療方案的可行性。
17.2 宮頸復發癌的治療方法
下面按不同的復發部位介紹其相應的治療方法:
17.2.1 (1)廣泛切除術後復發的治療
以放射治療爲主,對較大的復發竈可採用化療與放療綜合。
17.2.1.1 ①術後陰道殘端復發
一般採用體外照射與腔內放療結合的治療方法,但應有別於宮頸癌的常規放療。體外全盆照射腫瘤量(DT)40~45Gy/5~6周,陰道腔內後裝治療總劑量20Gy/3~4周。
17.2.1.2 ②陰道中下1/3復發
以腔內放療爲主,輔以體外照射。常選用陰道塞子容器進行分次腔內後裝治療,部分病例可採用組織間插植治療,其劑量應根據復發腫瘤體積、腫瘤消退情況、周圍正常組織的耐量等適當掌握,可參照陰道癌的治療(孫建衡,1994)。若腫瘤接近外陰,有可能切除者可行手術切除或術後再輔以腔內放療。
17.2.1.3 ③術後盆腔復發
以體外放療爲主,或化療與放療結合。體外放療常採用全盆照射方式,腫瘤量(DT)40~45Gy/5~6周,根據腫瘤縮小情況及放療副反應等,可考慮縮野後局部增加劑量5~10Gy。
術後有淋巴轉移的病人,和十大危險因素加起來,分數在13分以上的高危險羣,如能接受輔助性治療,也可能有效降低複發率。分析125位有淋巴轉移的病人,追蹤10年後,接受化療(6次PVB)的96位複發率爲34.4%(34/106),遠較沒接受化療的26位病人65.4%(17/26)的複發率低出甚多(P<0.01)。
與子宮廣泛手術和骨盆腔淋巴摘除手術治療的病人比較,都是早期子宮頸癌病人,複發率在10%~20%。因爲復發癌的治療不易,預後很差,病死率高達85%。復發的病人也只有13%能活過5年以上。其中影響最大的莫過於復發的部位。手術後密切追蹤複查也是很重要的一環。愈早發現,愈是中央復發癌,再治療後痊癒的機率愈高。
手術後已有復發癌的病人,由於大多數子宮頸癌復發癌還是以侷限性居多,因此能夠手術再次切除的仍以手術爲佳。切除後再看病理組織學檢查結果,再考慮放療、化療或者同時合併放療和化療治療。不能再次切除的復發癌,應該直接考慮放療、化療或合併兩者的治療。
17.2.2 (2)放療後復發的治療
17.2.2.1 ①中心性復發
原則上宜手術者儘可能行手術切除,但在放療區域內手術,難度較大,併發症較多,故須嚴格選擇病人。中央復發癌有時只侷限在陰道頂端,就是手術的陰道縫合處,不是抹片後有所發現,還以爲是手術後正常的肉芽組織。所有的HSIL和零期癌都可以行電灼和部分陰道切除。前者以電灼爲主,後者以部分陰道切除爲主,但是邊緣要夠,都有很好的結果。表淺的侵犯癌,做一個較廣泛的部分陰道切除未嘗不可。分析有手術後定期追蹤的病人,這類病人最多,多半可以做小而合併症也極小的手術。由於這部分病人的病竈多半靠近膀胱和直腸,因此膀胱和直腸黏膜也許會暴露出來,應該將它上面的陰道兩側黏膜縫合起來,同時在手術後放10天導尿管,並給病人服用一些軟便藥。如果標本檢查有肌肉層侵犯、邊緣都好的話,效果多半很好;如果邊緣不好、有癌細胞的話,還可以觀察一兩個月。有進展就是惡化,可考慮手術、放療或化療。
臺北榮總醫院子宮頸癌(1983~1999)的復發病人323位,綜合分析12%可接受手術治療。其中50%做骨盆腔臟器摘除術,約40%做局部切除,經由陰道做部分陰道切除居多,經由腹部做局部切除較少。不到10%經由陰道做激光或電灼以及冷凍等治療。兩年內病死率是38.1%,其中最壞的是經由腹部做局部切除和骨盆腔臟器摘除術,最好的是經由陰道做局部治療。
王浩、陳惠楨等(1990)認爲凡無手術禁忌證的中心性復發皆適於手術治療。實際上相當一部分病例不宜手術,如:①中心性復發伴臨牀難以判斷的宮旁復發;②術中探查發現盆腔外轉移或固定於盆壁的腫塊;③肥胖、老年患者或合併全身性疾患;④單側下肢水腫、坐骨神經痛和輸尿管梗阻,提示不能手術。王桂香等(1992)報道的83例中心性復發採用手術治療僅22例,佔26.5%。採取手術治療除嚴格掌握手術適應證外,還需恰如其分地選擇術式、充分的術前評估和準備、精心的術後護理等。
晚期中央復發癌,向前侵犯膀胱多於向後侵犯直腸。這類病人由於病竈仍侷限在骨盆腔中央,並沒有遠端或淋巴轉移,可以考慮將復發病竈鄰近器官如膀胱或直腸切除,並做相關的大便或小便出口,稱爲骨盆腔臟器廓清術(pelvic exenteration)。117位骨盆腔摘除手術中,以切除膀胱爲主的前骨盆腔臟器摘除術(anterior exenteration)最多,佔52.9%(62/117),依次是膀胱和直腸一起摘除的全臟器摘除(total exenteration)38.5%(45/117)和切除直腸的後臟器摘除(posterior exenteration)8.6%(10/117)。手術的死亡率是4.3%(5/117),2年存活率是28.2%(33/117),不因子宮頸癌而死亡的雖有4人,5年存活率仍有21.5%(23/107)。從最近5年看,已經沒有手術的死亡率,合併症如漏尿等也沒有。此外,許多全臟器摘除幾乎都可以前骨盆腔臟器摘除所取代,主要以侵犯膀胱居多,侵犯直腸的也有,很少而且也比較表淺,直腸表面可以剝離,最多就是部分直腸切除並再做吻合。在膀胱方面,可只做部分膀胱切除以及輸尿管再植,也就是部分骨盆腔臟器摘除(partial exenteration),以取代前骨盆腔臟器摘除。此外,在周邊復發癌中,有些病人也可以剝離,乾淨地切除。事實上,少數病人有單側腎盂水腫,還只是骨盆腔粘連引起而已。因此,不要輕易地放棄病人。手術前的正電子發射斷層(FDG-PET)檢查,可以幫助澄清一些錯誤的看法。因爲只有代謝活力的癌細胞對核素糖類FDG纔有極大的興趣,已經纖維化的組織細胞會降低對FIX3的吸收。
A.盆腔廓清術(pelvic exenteration):自Brunschwig(1948)首先用於宮頸復發癌的治療以來,40多年的經驗累積和相關學科的發展,至今已成爲少數晚期及放療後中心性復發(或未控)宮頸癌的一種可行的拯救性治療方法,手術存活率和生存質量不斷提高,病死率逐漸下降。劉熾明(1994)、張惜陰(1993)綜合國外文獻資料,5年生存率由20世紀50~60年代的22%~34.6%至70~80年代的32.3%~62.0%,手術死亡率由33.8%下降至3.0%。然而嚴重的手術併發症等問題限制了此類複雜手術的應用,因此國內外學者皆對此很慎重。近年Coleman等(1994)提示,在有些病例中可採用廣泛性子宮切除術代替盆腔廓清術。
B.廣泛性子宮切除術:20世紀80年代後有幾位作者認爲廣泛性子宮切除(包括盆腔淋巴結清掃術或部分盆腔和腹主動脈旁淋巴結取樣)適用於放療後未控及限於宮頸、病竈小且靜脈腎盂造影(IVP)正常的中心性復發者,結果提示可免行盆腔臟器切除而受益,但尿瘻的發生率仍很可觀。Rubin等(1987)、Coleman等(1994)報道5年生存率爲62%和72%,直腸或膀胱陰道瘻發生率47.6%和28%,手術死亡率9.5%(Rubin等,1987),術後併發症率爲42%(Coleman等,1994)。
C.次廣泛子宮切除或全子宮附件切除術:王桂香(1992)報道22例中心性復發手術治療的5年生存率爲64.8%,認爲行一般的全子宮附件切除即可。
對不宜手術的中心性復發是否予以再放療,需根據復發時間、初次放療的具體情況等決定再放療的方式、劑量及分割,再次放療的併發症會明顯增加,應高度重視。王桂香等(1992)報告61例中心性復發接受再放療,5年生存率僅26.6%,放療後併發症率爲23%。
17.2.2.2 ②放療後盆腔復發
多數對再次放療持否定態度,20世紀80年代後雖有作者報道再放療後的局部控制率達62%~64%,但併發症仍達15%~50%(Puthanala,1982)。Russell(1987)也認爲對嚴格選擇的病例再放療仍可收效。目前多采用盆腔內動脈灌注化療藥物和(或)姑息性放療。
17.2.2.3 ③遠處復發的治療
宮頸癌根治性治療後出現遠處復發,常有全身廣泛擴散或合併盆腔內復發,故宜予以化療爲主的綜合治療。少數病例如肺、肝的單發轉移竈可行手術切除,術後也需配合區域性化療。鎖骨上淋巴結轉移及骨轉移一般採用局部放療和輔以化療。
近年對晚期及復發宮頸癌的化療報道較多,異環磷酰胺(IFO)被認爲是宮頸復發癌最有效的單藥,總有效率爲33%,含順鉑的聯合化療有效率可達43%~78%,完全反應率爲15%~29%,異環磷酰胺(IFO)+順鉑(DDP)+博萊黴素(BLM)治療復發晚期轉移癌的有效率爲38%~69%。復發癌的姑息性全身化療效果仍不理想(Kruamr等,1991)。Lorvidnava (1991)均認爲動脈內化療可改善反應率;Kigawa等(1992)報告用順鉑(DDP)50mg/m2+博萊黴素(BLM)30mg/m2髂內動脈灌注治療21例宮頸復發癌,總有效率達71.4%;Verma等(1994)對限於盆腔的12例複發性鱗癌單用卡鉑(CBP)300~400mg/m2動脈化療,無1例有效;章文華等報道(1995)用介入療法,AP方案(E-ADM表柔比星+DDP順鉑)治療13例復發癌(部分合並姑息放療),近期有效率23.15,平均生存10個月,可見聯合化療優於單藥。
18 預後
宮頸復發癌的預後差,Manetta等(1992)報道1年存活率爲10%~15%,5年存活率<5%。綜合國內外文獻資料,影響復發癌預後的主要因素有:復發部位、病竈大小、復發間隔時間、初治方法及再治療方案等。
18.1 復發部位及病竈大小
二者均明顯影響預後,中心性復發較宮旁及盆腔外復發預後好,有遠處轉移者預後更差,如骨轉移、鎖骨上淋巴結轉移者平均生存均不到10個月,俞高志等(1994)報告130例骨轉移中僅1例生存5年以上。Coleman等(1994)報道侷限於宮頸、小於2cm的復發病竈、靜脈腎盂造影(IVP)正常者與病竈大於2cm者比較,採用根治性子宮切除術後其5年生存率有顯著差異,分別爲90%和64%,10年生存率爲80%和48%,中位生存148個月和87個月。
骨轉移極少見約佔1.8%,最常見的是病竈從腹主動脈旁淋巴結延伸擴散侵犯至附近的脊柱。骨轉移發生最早的時間爲首次診斷後8個月,最長間距爲13年。69%的患者在第一次治療後30個月內做出診斷,96%患者18個月內死亡。
關於復發癌及持續復發的部位,在根治手術後,1/4復發癌發生在陰道上段或術前宮頸部位。放射治療後27%發生在宮頸、子宮或陰道上段,6%在陰道2/3,43%在宮旁結締組織包括骨盆壁,16%遠處轉移,8%不詳。
患者放射治療以後可以出現輸尿管梗阻現象,而在治療前其功能是正常的。輸尿管梗阻可能是由於放射後纖維化引起,但95%的梗阻是由於病情進展而引起。如果中心性病竈不明顯,患者治療後出現找不到其他原因能引起的輸尿管梗阻,應進行剖腹探查,並做選擇性的活檢以明確復發癌的診斷。如無復發癌存在而有輸尿管梗阻即應考慮做排尿改道。
18.2 復發時間
復發間隔時間長,組織對再放療的耐受相對增加,並由於血管修復和側支再建,達到局部病竈的化療藥物濃度增加,因此有利於改善復發再治療的效果,張曉春等(1995)報道2年後復發的預後明顯好於2年內復發者,中位生存分別爲18個月和10個月。
18.3 初始方法
有放療史者預後差,Verma等(1994)報道盆腔放療區域內復發竈對化療的反應率僅15%~20%,盆腔外轉移的化療反應率爲50%。張曉春等(1995)報道術後復發的預後明顯好於手術加放療及單純放療後復發,中位生存分別爲24個月、12個月和10個月。Long等(1995)應用聯合化療治療晚期復發癌,結果提示有無放療史的反應率明顯不同(61%∶83%),50%死於1年內,85%死於3年內。
18.4 再治療方法
與預後密切相關,經手術治療的復發癌5年生存率高於其他手段治療後的病例。劉熾明(1994)綜合文獻報道盆腔廓清術後的5年存活率爲22%~58%。張曉春等(1995)總結術後復發經放射治療後中位生存24個月,而放療後復發經再放療和(或)化療者預後差,中位生存僅10~12個月。