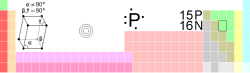
4 磷的特性
總體特性原子屬性物理屬性其他性質穩定的同位素在沒有特別註明的情況下使用的是
國際標準基準單位單位和標準氣溫和氣壓
| |||||||||||||
| 名稱, 符號, 序號 | 磷、P、15 | ||||||||||||
| 系列 | 非金屬 | ||||||||||||
| 族, 週期, 元素分區 | 15族(VA), 3, p | ||||||||||||
| 密度、硬度 | 白磷: 1823 kg/m3,NA 黑磷: 2670 kg/m3,NA | ||||||||||||
| 顏色和外表 | 無色 / 紅色 / 銀白色 | ||||||||||||
| 地殼含量 | 0.09 % | ||||||||||||
| 原子量 | 30.973762(2)原子量單位 | ||||||||||||
| 原子半徑 (計算值) | 100(98)pm | ||||||||||||
| 共價半徑 | 106 pm | ||||||||||||
| 範德華半徑 | 180 pm | ||||||||||||
| 價電子排布 | [氖]3s23p3 | ||||||||||||
| 電子在每能級的排布 | 2,8,5 | ||||||||||||
| 氧化價(氧化物) | ±3,5,4(弱酸性) | ||||||||||||
| 晶體結構 | 單斜晶體 | ||||||||||||
| 物質狀態 | 固態 | ||||||||||||
| 熔點 | 317.3 K(44.2 °C) | ||||||||||||
| 沸點 | 550 K (277 °C) | ||||||||||||
| 摩爾體積 | 17.02×10-6m3/mol | ||||||||||||
| 汽化熱 | 12.129 kJ/mol | ||||||||||||
| 熔化熱 | 0.657 kJ/mol | ||||||||||||
| 蒸氣壓 | 20.8 帕(294K) | ||||||||||||
| 聲速 | 無數據 | ||||||||||||
| 電負性 | 2.19(鮑林標度) | ||||||||||||
| 比熱 | 1040 J/(kg·K) | ||||||||||||
| 電導率 | 1.0×10-9/(米歐姆) | ||||||||||||
| 熱導率 | 0.235 W/(m·K) | ||||||||||||
| 第一電離能 | 1011.8 kJ/mol | ||||||||||||
| 第二電離能 | 1907 kJ/mol | ||||||||||||
| 第三電離能 | 2914.1 kJ/mol | ||||||||||||
| 第四電離能 | 4963.6 kJ/mol | ||||||||||||
| 第五電離能 | 6273.9 kJ/mol | ||||||||||||
| 同位素丰度半衰期衰變模式衰變能量 MeV衰變產物
| |||||||||||||
5 性狀
磷的是一種易起化學反應的、有毒的氮族非金屬元素。它的化學反應活性和毒性取決於形態不同而有所區別。
5.1 單質磷的同素異形體
黑磷(金屬磷) 化學結構類似石墨,因此可導電。 化學式一般寫爲P。 深黑色粉末 白磷(黃磷) 化學式:P4 淡黃蠟似半透明可結晶的固體,於黑暗中能發光。有特臭,劇毒。比重1.83,熔點44.4,沸點287度。 紅磷(赤磷) 化學結構爲巨型共價分子。 化學式一般寫爲P。 鮮紅色粉末,無毒,比重2.296,熔點725度,是黃磷於壓力下惰氣中加熱8-10日而成 紫磷 化學結構爲層狀,但與黑磷不同。 化學式一般寫爲P。
6 磷元素的發現
在化學史上第一個發現磷元素的人,當推十七世紀的一個德國漢堡商人波蘭特(Henning·Brand,約1630年~約1710年)。他是一個相信鍊金術的人,由於他曾聽傳說從尿裏可以製得“金屬之王”黃金,於是抱着圖謀發財的目的,便用尿作了大量實驗。1669年,他在一次實驗中,將砂、木炭、石灰等和尿混合,加熱蒸餾,雖沒有得到黃金,而竟意外地得到一種十分美麗的物質,它色白質軟,能在黑暗的地方放出閃爍的亮光,於是波蘭特給它取了個名字,叫“冷光”,這就是今日稱之爲白磷的物質。波蘭特對制磷之法,起初極守祕密,不過,他發現這種新物質的消息立刻傳遍了德國。
德國化學家孔克爾曾用盡種種方法想打聽出這一祕密的製法,終於探知這種所謂發光的物質,是由尿裏提取出來的,於是他也開始用尿做試驗,經過苦心摸索,終於在1678年也告成功。他是把新鮮的尿蒸餾,待蒸到水分快乾時,取出黑色殘渣,放置在地窯裏,使它腐爛,經過數日後,他將黑色殘渣取出,與兩倍於“尿渣”重的細砂混合。一起放置在曲頸瓶中,加熱蒸餾,瓶頸則接連盛水的收容器。起初用微火加熱,繼用大火乾餾,及至尿中的揮發性物質完全蒸發後,磷就在收容器中凝結成爲白色蠟狀的固體。後來,他爲介紹磷,曾寫過一本書,名叫《論奇異的磷質及其發光丸》。
在磷元素的發現上,英國化學家波義爾差不多與孔克爾同時,用與他相近的方法也製得了磷。波義爾的學生漢克維茨(Codfrey·Hanckwitz)曾用這種方法在英國製得較大量的磷,作爲商品運到歐洲其他國家出售。他在1733年曾發表論文,介紹制磷的方法,不過說得十分含糊,以後,又有人從動物骨質中發現了磷。
9 磷的製備
磷的現代製法是將磷酸鈣與砂(主要成分爲二氧化硅)及焦炭一起放在電爐中加熱。爲使反應式易於理解,可寫成兩步如下:
Ca3(PO4)2+3SiO2=3CaSiO3+P2O5P2O5+5C=2P+5CO
11 磷的含氧酸
磷有5種比較重要的含氧酸:
| 磷酸(正磷酸) | H3PO4 | +5 |  | 3 |
| 焦磷酸 | H4P2O7 | +5 | OH OH | | O = P - O - P = O | | OH OH | 4 |
| 偏磷酸 | HPO3 | +5 | O \\ P - OH // O | 1 |
| 亞磷酸 | H3PO3 | +3 | OH | H - P = O | OH | 2 |
| 次磷酸 | H3PO2 | +1 | OH | H - P = O | H | 1 |
用途
磷可用於安全火柴、煙花、燃燒彈和化肥,還可以保護金屬表面免於腐蝕。
磷酸的用途也十分廣泛。
12 人體中磷的含量
磷占人體重的0.8%~1.1%,其中80%~90%與鈣結合共存於骨骼和牙齒中,其餘的以磷脂、磷蛋白、磷酸鹽的形式存在於細胞和血液中。正常成年人體內磷的總含量約爲400~800g;血中磷的濃度爲0.79~1.61mmol/L,兒童血磷濃度稍高,爲1.29~1.94mmol/L[2][3]。
磷是骨骼和牙齒的構成材料之一。磷能保持人體內代謝平衡,在調節能量代謝過程中發揮重要作用。它是生命物質核苷酸的基本成分。它參與體內的酸鹼平衡的調節,參與體內脂肪的代謝。
16 磷中毒
磷的用途甚廣,在製造火柴、焰火、爆竹、信號彈、某些合成染料、人造磷肥、殺蟲劑、滅鼠藥及醫療用藥中,均應用磷。舊式火柴頭藥含有黃磷,劇毒。目前生產的日用火柴頭藥內無磷,但在有些火柴盒的邊藥中含赤磷40%左右。任何地方都可擦燃的硫化磷火柴的頭藥內含有三硫化四磷(P4S3)10%左右,有毒。多由於誤服含磷的滅鼠藥如磷化鋅所致,偶由吞食含黃磷的火柴頭引起;若多次嚼食含磷化物或赤磷的火柴盒邊,亦可出現中毒症狀,赤磷中一般含有0.6%~1%黃磷。由於吸入黃磷煙霧或磷化氫中毒者甚少。[4]
16.1 毒理作用
黃磷毒性甚劇,對成人的最小致死量約爲60~100mg,磷化鋅的致死量約爲40mg/kg。
黃磷進入人體後,其毒理作用爲破壞細胞內酶的功能,主要造成肝、心、腎等實質臟器的損害,引起上述臟器及橫紋肌等脂肪變性,外周循環衰竭,骨骼脫鈣及出血等。此外,黃磷對皮膚及黏膜均可引起強烈的灼傷和腐蝕,並可通過創面吸收中毒。
磷化鋅進入體內與胃酸作用後產生磷化氫和氯化鋅,二者對胃腸道黏膜有刺激和腐蝕作用,引起炎症、充血、潰瘍和出血等。其所產生的磷化氫還作用於細胞酶,影響細胞代謝, 使細胞發生內窒息,以致中樞神經、呼吸、心血管系統及肝、腎功能均受影響,而以中樞神經系統受害最早亦最重。
16.2 臨牀表現
誤食含黃磷的火柴頭或其他含磷製劑後半小時至數小時內,患者口腔、食道和胃內有燒灼樣疼痛,並出現噁心、嘔吐、腹痛、腹瀉,嘔吐物及糞便有大蒜臭味,在黑暗處可見熒光。輕症可於1周內逐漸恢復。重症患者的嘔吐物和糞便帶血,甚至大量嘔血,可於1~2d內出現昏迷、休克,導致死亡。若誤服量甚大時,可以迅速發生休克而無明顯的嘔吐、腹痛和腹瀉。部分患者可在1~3d的症狀好轉後出現吸收中毒的症狀,再度吐、瀉、腹痛,吐、瀉物可爲血性,肝臟腫大,黃疸,鼻出血及皮下出血,嚴重者發生呼吸困難、痙攣、肝、腎衰竭,譫妄,血壓下降,昏迷等,可在1~3周內死亡。少數患者的食管或胃腸因腐蝕導致穿孔。
誤食磷化物(如磷化鋅等)後,除出現胃腸道症狀外,較快發生肺水腫、黃疸等,同時可有神經系統症狀如頭暈、全身麻木、抽搐、神志模糊、昏迷以及循環系統症狀如心悸、血壓降低、心律緩慢及心肌損害等。
若吸人大量黃磷煙霧或磷化氫,患者在十幾分鍾內即有呼吸困難,繼後發生肺水腫等症狀,可於短期內死亡。
16.3 實驗室檢查
嘔吐物及糞便中可檢出磷,在夜間或暗處可發磷光。血液檢查可有白細胞及血小板減少、血糖降低、膽固醇、膽紅素、磷、鈣等增加,凝血酶原降低,出、凝血時間延長。尿量少,可出現蛋白、紅細胞及管型等。[4]
16.4 治療
口服中毒而無胃出血者在5h內均須立即用1:5000高錳酸鉀溶液或0.1%硫酸銅溶液小心洗胃,直至洗出液澄清而無蒜臭味爲止;若無法立即洗胃,則可內服0.5%硫酸銅溶液適量(成人4ml,小兒酌減),15min/次,共服2~3次或至發生嘔吐爲止(昏迷患者仍應洗胃)。必須注意所用硫酸銅溶液不可過濃、過多,洗胃液出入量應大致相等,防止發生銅中毒。亦可先灌注適量液體石蠟於胃中,再以大量清水洗胃。洗胃後連續數日給予硫酸鈉或液體石蠟等瀉劑,因吞服黃磷後2~3d,糞便中仍可檢出該類毒物。禁用硫酸鎂,因其可與氯化鋅(磷化鋅在胃內遇酸後生成物之一)起作用後生成滷鹼,引起中毒。液體石蠟可使磷溶解於其中而被瀉出,且不爲胃腸道吸收。勿用其他油類及含脂肪的物質如牛奶等,以防促進磷的吸收。靜脈注射適量50%葡萄糖溶液和大量維生素C以及保肝藥物。嚴重患者可加用換血療法。有出血現象時,根據病情選用維生素K、對羧基節胺及其他止血藥物。餘爲輸液、維持營養和對症處理。
若爲吸入黃磷煙霧或磷化氫中毒,迅速將患者移至新鮮空氣處,更換污染衣服;皮膚若被沾染,立即選用1%硫酸銅溶液、2%碳酸氫鈉溶液或2%過氧化氫溶液沖洗皮膚;其他爲搶救肺水腫,並按上述有關項目處理。
16.5 預防
勿讓小兒玩耍火柴。滅鼠藥物應作標記,晚上放在鼠洞旁,白天拿掉,以免小兒撿食誤服;不用的滅鼠藥須妥爲收藏。教育小兒勿到用磷化氫等燻蒸的場所玩耍。[6]